Comparing aryltetralin lignan accumulation patterns in four biotechnological systems of Linum album
1
2018
... 木脂素是一类由两分子苯丙素单元氧化聚合而成的植物次级代谢产物.木脂素主要功能是保护植物避免遭受食草动物和微生物的侵害,多具有抗细菌、抗病毒和抗真菌活性[1].木脂素能抵御活性氧,保护种子中的油脂不被氧化.木脂素在月桂科植物中含量丰富,特别是润楠属、樟桂属和甘蜜树属[2].然而,植物天然产物通过植物生物质加工获得,需要持续的土地、水和时间投入.虫害或极端天气造成木脂素含量的不确定性影响了植物天然产物的加工提取[3]. ...
Chemical structures of lignans and neolignans isolated from Lauraceae
1
2018
... 木脂素是一类由两分子苯丙素单元氧化聚合而成的植物次级代谢产物.木脂素主要功能是保护植物避免遭受食草动物和微生物的侵害,多具有抗细菌、抗病毒和抗真菌活性[1].木脂素能抵御活性氧,保护种子中的油脂不被氧化.木脂素在月桂科植物中含量丰富,特别是润楠属、樟桂属和甘蜜树属[2].然而,植物天然产物通过植物生物质加工获得,需要持续的土地、水和时间投入.虫害或极端天气造成木脂素含量的不确定性影响了植物天然产物的加工提取[3]. ...
Synthetic biology strategies for microbial biosynthesis of plant natural products
2
2019
... 木脂素是一类由两分子苯丙素单元氧化聚合而成的植物次级代谢产物.木脂素主要功能是保护植物避免遭受食草动物和微生物的侵害,多具有抗细菌、抗病毒和抗真菌活性[1].木脂素能抵御活性氧,保护种子中的油脂不被氧化.木脂素在月桂科植物中含量丰富,特别是润楠属、樟桂属和甘蜜树属[2].然而,植物天然产物通过植物生物质加工获得,需要持续的土地、水和时间投入.虫害或极端天气造成木脂素含量的不确定性影响了植物天然产物的加工提取[3]. ...
... 微生物法生产植物天然产物具有很多优点,包括:(1)根据微生物细胞合成能力按需合成产品;(2)发酵工艺可以放大并且易于控制;(3)能合成比天然植物宿主纯度和产量更高的植物天然产物及其中间代谢产物[3].近年来,天然产物合成得到迅猛发展,比如利用酿酒酵母实现了大麻素和非天然结构类似物的从头合成[72],利用大肠杆菌成功合成紫杉醇前体紫杉二烯[73]和紫杉二烯氧化产物[74].目前,松柏醇和松脂素的微生物法生产为复杂的木脂素化合物的生物合成奠定了良好的基础. ...
Improving bioconversion of eugenol to coniferyl alcohol by in situ eliminating harmful H2O2
2
2018
... 代谢工程和合成生物学的发展,为微生物合成木脂素奠定了良好的基础,如在大肠杆菌中合成木脂素的重要前体物松柏醇[4-5]和松脂素[6],在酿酒酵母中合成松柏醇[7]和芝麻素[8]等.随着木脂素在植物中的合成路径不断被解析,越来越多的人们关注采用微生物法合成木脂素的可行性.本文基于木脂素类化合物的结构和生物合成路径的解析,总结了当前微生物法生产木脂素的研究进展,并对如何进一步提升微生物法合成木脂素类化合物的效率进行了展望. ...
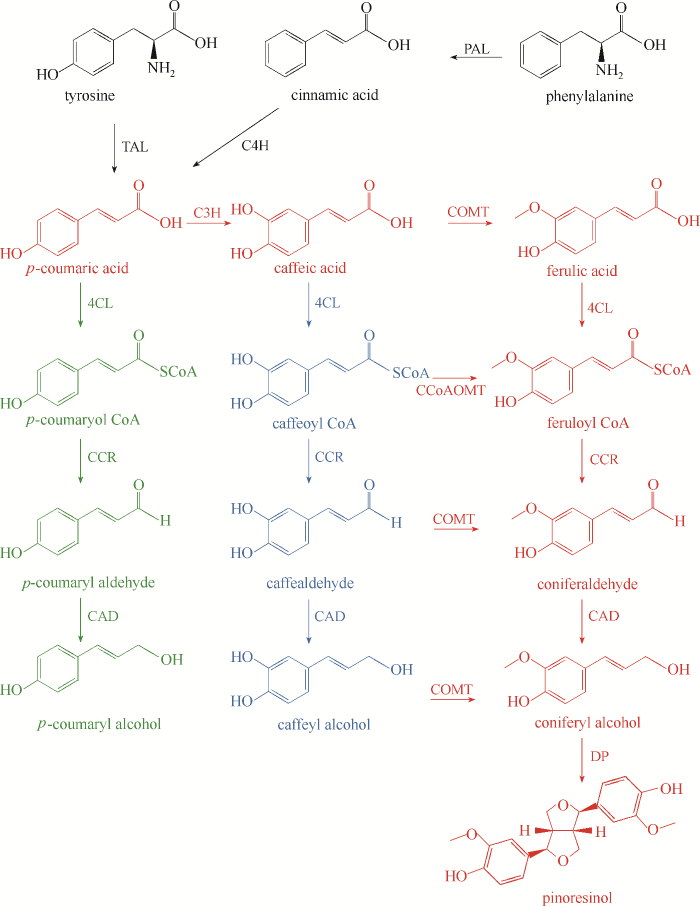
... 利用微生物法生产松柏醇反应条件温和,合成产物的专一性高,具体方法包括酶法合成和从头合成.Lv等[4]以廉价的丁香酚为底物,在大肠杆菌体内表达简青霉来源的香草醇氧化酶PsVAO合成松柏醇.PsVAO在催化过程释放有害副产物H2O2,过量的H2O2积累会导致PsVAO的活性受到抑制和细胞毒性.因为过氧化氢酶具备高过氧化氢酶活性和低过氧化物酶活性,所以选择将不同来源的过氧化氢酶引入生物转化系统.通过过氧化氢酶原位消除H2O2能解除H2O2对PsVAO的限制、提高松柏醇产量和防止松柏醇过度氧化.最终,松柏醇的产量为22.9 g/L,转化率为78.7%.Aschenbrenner等[75]在大肠杆菌体内构建了木质素单体的合成路径,加入2.5 mmol/L阿魏酸后,可以得到1.82 mmol/L松柏醇,远高于其他肉桂酸衍生物的转化效率.Chen等[5]根据植物体内松柏醇合成路径在大肠杆菌体内组合表达了TAL、4CL1、CCR和ADH实现对香豆醇的合成.然后,采用活性更高的HpaBC替代植物来源的C3H催化对香豆醇向咖啡醇的转化.考虑到HpaBC偏好以对香豆醇为底物,在发酵过程中优先积累对香豆醇.最终采用微生物共培养在大肠杆菌中重构松柏醇的从头合成路径,在2.5 L生物反应器上放大生产得到(124.9 ± 5.1) mg/L松柏醇和(232.9 ± 15.1) mg/L咖啡醇.Yang等[7]在酿酒酵母中从头合成松柏醇时,选择首先合成阿魏酸,通过将AtCOMT1、PaHpaB和EcHpaC整合到Ty4位点后,再共表达At4CL5、AtCAD5和AtCCR1,并结合NADPH的强化过表达zwf1和TYR1,松柏醇在摇瓶水平的积累量46.6 mg/L.在5 L生物反应器中放大生产,酿酒酵母最终积累201.1 mg/L松柏醇.酶法合成能够获得较高的松柏醇产量和底物转化效率;从头合成为工程菌株工业化生产提供了可能性. ...
Metabolic engineering of Escherichia coli for microbial synthesis of monolignols
2
2017
... 代谢工程和合成生物学的发展,为微生物合成木脂素奠定了良好的基础,如在大肠杆菌中合成木脂素的重要前体物松柏醇[4-5]和松脂素[6],在酿酒酵母中合成松柏醇[7]和芝麻素[8]等.随着木脂素在植物中的合成路径不断被解析,越来越多的人们关注采用微生物法合成木脂素的可行性.本文基于木脂素类化合物的结构和生物合成路径的解析,总结了当前微生物法生产木脂素的研究进展,并对如何进一步提升微生物法合成木脂素类化合物的效率进行了展望. ...
... 利用微生物法生产松柏醇反应条件温和,合成产物的专一性高,具体方法包括酶法合成和从头合成.Lv等[4]以廉价的丁香酚为底物,在大肠杆菌体内表达简青霉来源的香草醇氧化酶PsVAO合成松柏醇.PsVAO在催化过程释放有害副产物H2O2,过量的H2O2积累会导致PsVAO的活性受到抑制和细胞毒性.因为过氧化氢酶具备高过氧化氢酶活性和低过氧化物酶活性,所以选择将不同来源的过氧化氢酶引入生物转化系统.通过过氧化氢酶原位消除H2O2能解除H2O2对PsVAO的限制、提高松柏醇产量和防止松柏醇过度氧化.最终,松柏醇的产量为22.9 g/L,转化率为78.7%.Aschenbrenner等[75]在大肠杆菌体内构建了木质素单体的合成路径,加入2.5 mmol/L阿魏酸后,可以得到1.82 mmol/L松柏醇,远高于其他肉桂酸衍生物的转化效率.Chen等[5]根据植物体内松柏醇合成路径在大肠杆菌体内组合表达了TAL、4CL1、CCR和ADH实现对香豆醇的合成.然后,采用活性更高的HpaBC替代植物来源的C3H催化对香豆醇向咖啡醇的转化.考虑到HpaBC偏好以对香豆醇为底物,在发酵过程中优先积累对香豆醇.最终采用微生物共培养在大肠杆菌中重构松柏醇的从头合成路径,在2.5 L生物反应器上放大生产得到(124.9 ± 5.1) mg/L松柏醇和(232.9 ± 15.1) mg/L咖啡醇.Yang等[7]在酿酒酵母中从头合成松柏醇时,选择首先合成阿魏酸,通过将AtCOMT1、PaHpaB和EcHpaC整合到Ty4位点后,再共表达At4CL5、AtCAD5和AtCCR1,并结合NADPH的强化过表达zwf1和TYR1,松柏醇在摇瓶水平的积累量46.6 mg/L.在5 L生物反应器中放大生产,酿酒酵母最终积累201.1 mg/L松柏醇.酶法合成能够获得较高的松柏醇产量和底物转化效率;从头合成为工程菌株工业化生产提供了可能性. ...
Engineering of an H2O2 auto-scavenging in vivo cascade for pinoresinol production
2
2017
... 代谢工程和合成生物学的发展,为微生物合成木脂素奠定了良好的基础,如在大肠杆菌中合成木脂素的重要前体物松柏醇[4-5]和松脂素[6],在酿酒酵母中合成松柏醇[7]和芝麻素[8]等.随着木脂素在植物中的合成路径不断被解析,越来越多的人们关注采用微生物法合成木脂素的可行性.本文基于木脂素类化合物的结构和生物合成路径的解析,总结了当前微生物法生产木脂素的研究进展,并对如何进一步提升微生物法合成木脂素类化合物的效率进行了展望. ...
... 在植物体内,两分子松柏醇通过同化蛋白的催化生成松脂素.松柏醇的高效微生物合成为松脂素合成奠定了基础.目前,松脂素的合成以酶法生产为主.酶催化中通过级联反应实现产物的一步合成具有很多优势,包括省时、省力、简化多步反应,避免中间产物的分离和纯化.Ricklefs等[76]构建了香草醇氧化酶和漆酶偶联的两步一锅法,利用丁香酚通过以松柏醇为中间产物合成松脂素.首先通过简青霉来源的香草醇氧化酶PsVAO和不同类型的细菌来源的漆酶共表达筛选最佳的合成松脂素的组合.再通过发酵条件的优化,松脂素最高产量达到1.6 g/L.在前期酶催化的基础上,Ricklefs等[77]构建了三步一锅法,利用全细胞催化合成了ee值高达98%的(+)-松脂素,通过表达金钟连翘来源的松脂素/落叶松脂素还原酶(FiPLR)获得了ee值高达97%的(+)-松脂素.Lv等[6]在体内构建了PsVAO和过氧化物酶共表达的体内H2O2自消除的松柏醇合成体系.为了平衡代谢流,PsVAO和过氧化物酶采用不同的连接方式进行表达.通过发酵条件的优化,松脂素的产量达到11.29 g/L,转化率为52.77%.在大肠杆菌中表达的过氧化物酶大部分属于apo-蛋白,培养基中添加适量的5-氨基乙酰丙酸可以增加全蛋白的合成[78].因此,增加大肠杆菌胞内血红素合成可以提高过氧化物酶的活性.令人意外的是,在大肠杆菌体内表达不同拷贝数的hemA和hemL基因时,松脂素的产量均下降.利用过氧化物酶偶联PsVAO合成松脂素的过程还需要考虑从其他角度优化代谢过程,比如阻断血红素降解途径[79]增加血红素和过氧化物酶的结合,进一步提高丁香酚向松脂素的转化效率. ...
Green production of silybin and isosilybin by merging metabolic engineering approaches and enzymatic catalysis
2
2020
... 代谢工程和合成生物学的发展,为微生物合成木脂素奠定了良好的基础,如在大肠杆菌中合成木脂素的重要前体物松柏醇[4-5]和松脂素[6],在酿酒酵母中合成松柏醇[7]和芝麻素[8]等.随着木脂素在植物中的合成路径不断被解析,越来越多的人们关注采用微生物法合成木脂素的可行性.本文基于木脂素类化合物的结构和生物合成路径的解析,总结了当前微生物法生产木脂素的研究进展,并对如何进一步提升微生物法合成木脂素类化合物的效率进行了展望. ...
... 利用微生物法生产松柏醇反应条件温和,合成产物的专一性高,具体方法包括酶法合成和从头合成.Lv等[4]以廉价的丁香酚为底物,在大肠杆菌体内表达简青霉来源的香草醇氧化酶PsVAO合成松柏醇.PsVAO在催化过程释放有害副产物H2O2,过量的H2O2积累会导致PsVAO的活性受到抑制和细胞毒性.因为过氧化氢酶具备高过氧化氢酶活性和低过氧化物酶活性,所以选择将不同来源的过氧化氢酶引入生物转化系统.通过过氧化氢酶原位消除H2O2能解除H2O2对PsVAO的限制、提高松柏醇产量和防止松柏醇过度氧化.最终,松柏醇的产量为22.9 g/L,转化率为78.7%.Aschenbrenner等[75]在大肠杆菌体内构建了木质素单体的合成路径,加入2.5 mmol/L阿魏酸后,可以得到1.82 mmol/L松柏醇,远高于其他肉桂酸衍生物的转化效率.Chen等[5]根据植物体内松柏醇合成路径在大肠杆菌体内组合表达了TAL、4CL1、CCR和ADH实现对香豆醇的合成.然后,采用活性更高的HpaBC替代植物来源的C3H催化对香豆醇向咖啡醇的转化.考虑到HpaBC偏好以对香豆醇为底物,在发酵过程中优先积累对香豆醇.最终采用微生物共培养在大肠杆菌中重构松柏醇的从头合成路径,在2.5 L生物反应器上放大生产得到(124.9 ± 5.1) mg/L松柏醇和(232.9 ± 15.1) mg/L咖啡醇.Yang等[7]在酿酒酵母中从头合成松柏醇时,选择首先合成阿魏酸,通过将AtCOMT1、PaHpaB和EcHpaC整合到Ty4位点后,再共表达At4CL5、AtCAD5和AtCCR1,并结合NADPH的强化过表达zwf1和TYR1,松柏醇在摇瓶水平的积累量46.6 mg/L.在5 L生物反应器中放大生产,酿酒酵母最终积累201.1 mg/L松柏醇.酶法合成能够获得较高的松柏醇产量和底物转化效率;从头合成为工程菌株工业化生产提供了可能性. ...
Formation of two methylenedioxy bridges by a sesamum CYP81Q protein yielding a furofuran lignan, (+)-sesamin
3
2006
... 代谢工程和合成生物学的发展,为微生物合成木脂素奠定了良好的基础,如在大肠杆菌中合成木脂素的重要前体物松柏醇[4-5]和松脂素[6],在酿酒酵母中合成松柏醇[7]和芝麻素[8]等.随着木脂素在植物中的合成路径不断被解析,越来越多的人们关注采用微生物法合成木脂素的可行性.本文基于木脂素类化合物的结构和生物合成路径的解析,总结了当前微生物法生产木脂素的研究进展,并对如何进一步提升微生物法合成木脂素类化合物的效率进行了展望. ...
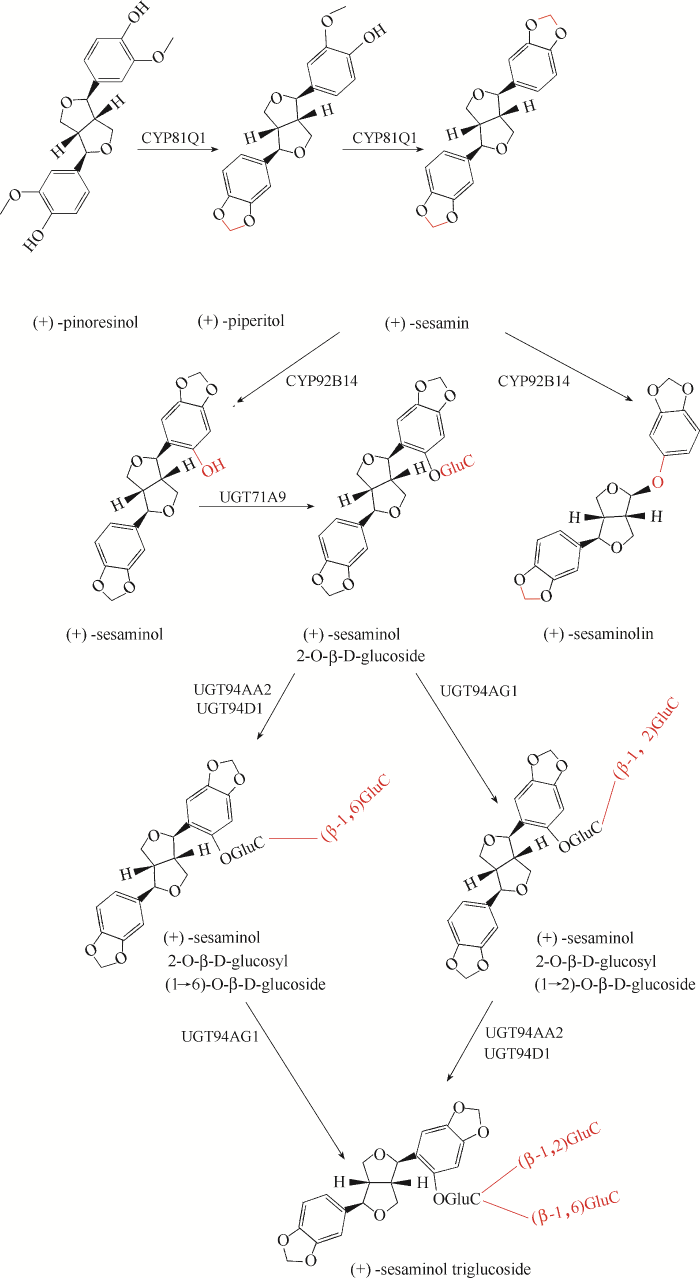
... 芝麻(胡麻科,芝麻属)富含各种生物活性物质,包括木脂素、生育酚类似物、植物甾醇等.在芝麻种子里,两分子松脂素之间形成亚甲基二氧桥合成(+)-胡椒醇,再以相同的方式合成(+)-芝麻素.Ono等[8]发现芝麻中(+)-芝麻素和(+)-胡椒醇的合成(图4)都是经过CYP81Q1催化.经比较,CYP81Q1和同样催化亚甲二氧桥形成的CYP719A1的氨基酸序列一致性只有24%.CYP81Q1在芝麻中还存在两种同源蛋白,分别是S. radiatum来源的CYP81Q2和S. alatum来源的CYP81Q3.两种蛋白和CYP81Q1的结构相似,只有CYP81Q2和CYP81Q1表现出相同的NADPH依赖型胡椒醇合成酶活性.利用LC-MS检测S. alatum的木脂素组成,主要有(+)-2-episesalatin、(+)-alatumin和(+)-新木脂体柄果脂素[57].共表达CYP81Q3和细胞色素还原酶(CPR1)的酵母细胞,加入(+)-表松脂素,被彻底转化为(+)-新木脂体柄果脂素[57]. ...
... 木脂素化合物的合成主要通过植物提取法,微生物法生产鲜有报道.木脂素化合物的研究集中在木脂素化合物的衍生化、药用价值和代谢路径的解析.芝麻素及其衍生物的关键酶在酿酒酵母和大肠杆菌中的功能鉴定为木脂素的微生物法生产奠定了基础.Ono等[8]在酵母INVsc中表达CYP81Q1后收集微粒体,并加入辅因子NADPH和(+)-松脂素,反应结束后通过HPLC检测到(+)-胡椒醇和(+)-芝麻素的生成.Murata等[58]从表达CYP92B14 和CPR1酵母细胞提取的微粒体,可以将芝麻素转化为芝麻林素和芝麻素酚.通过比较发现,当CYP92B14和CPR1共表达时,催化活性会显著提高;当CYP92B14单独表达时,只有微量的芝麻林素合成.以芝麻素为底物时,共表达CYP81Q1、CYP92B14和CPR1的酵母比单独表达CYP92B14和CPR1的细胞积累更多的芝麻林素和芝麻素酚,而且底物被完全消耗.另一方面,CYP81Q1不能单独作用于芝麻素,CYP92B14不能单独作用于松脂素和胡椒醇.CYP92B14和CYP81Q1在功能上的联系说明功能互作的酶类存在新的结构和功能的关系.Chandra等[80]在大肠杆菌中表达纯化CYP81Q1和CPR1用于芝麻素的体外合成.在CPR1存在的条件下,CYP81Q1催化松脂素合成芝麻素的能力大幅度提升.考虑到PLR或者是其他合成木脂素相关的细胞色素P450基因属于NADPH依赖型,还需要进一步提高细胞内NADPH/NADP+的比例[81-83],兼顾细胞生长和产物合成的平衡关系.此外,表达细胞色素P450时还需要筛选合适的CPR优化蛋白的表达水平[84]. ...
Diversity in lignan biosynthesis
1
2003
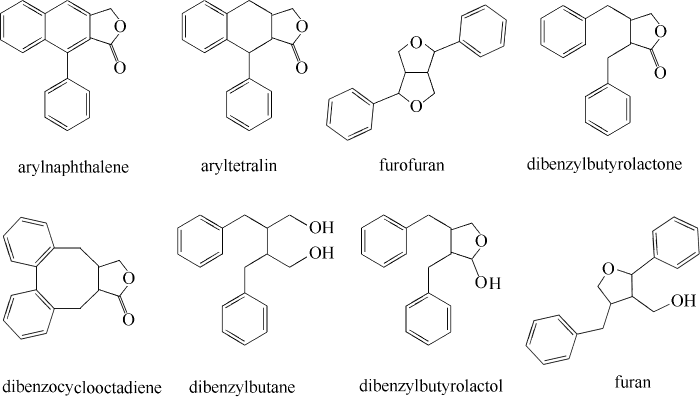
... 木脂素类化合物根据结构类型分为8种(图1):芳基萘(arylnaphthalene)、芳基四氢萘(aryltetralin)、双并四氢呋喃(furofuran)、二苄基丁内酯(dibenzylbutyrolactone)、二苯并环辛二烯(dibenzocyclooctadiene)、二芳基丁烷(dibenzylbutane)、二苄基丁酸乳酯(dibenzylbutyrolactol)、呋喃(furan)[9].木脂素类化合物还能根据苯环和丙基侧链的氧化程度分为3类:带有C9 (C9′)-氧的木脂素、无C9 (C9′)-氧的木脂素和二羧酸木脂素.带有C9(C9′)-氧的木脂素类研究最为广泛,包括落叶松脂素(lariciresinol)、开环异落叶松脂素(secoisolaricisiresinol,SECO)、罗汉松脂素(matairesinol)等[10]. ...
Characterization of Arabidopsis thaliana pinoresinol reductase, a new type of enzyme involved in lignan biosynthesis
3
2008
... 木脂素类化合物根据结构类型分为8种(图1):芳基萘(arylnaphthalene)、芳基四氢萘(aryltetralin)、双并四氢呋喃(furofuran)、二苄基丁内酯(dibenzylbutyrolactone)、二苯并环辛二烯(dibenzocyclooctadiene)、二芳基丁烷(dibenzylbutane)、二苄基丁酸乳酯(dibenzylbutyrolactol)、呋喃(furan)[9].木脂素类化合物还能根据苯环和丙基侧链的氧化程度分为3类:带有C9 (C9′)-氧的木脂素、无C9 (C9′)-氧的木脂素和二羧酸木脂素.带有C9(C9′)-氧的木脂素类研究最为广泛,包括落叶松脂素(lariciresinol)、开环异落叶松脂素(secoisolaricisiresinol,SECO)、罗汉松脂素(matairesinol)等[10]. ...
... 木脂素的生物合成引起了广泛关注,其原因包括:(1)木脂素的生物合成涉及独特的立体化学性质;(2)木脂素具有很多重要的临床生物活性;(3)木脂素及其衍生物,如去甲木脂素通过生物合成大量积累在树的心材区域 [10].苯丙氨酸和酪氨酸是单宁、木质素和木脂素合成的前体.苯丙氨酸通过苯丙氨酸解氨酶生成肉桂酸(图3),接着经过肉桂酸-4-羟化酶催化生成对香豆酸,或者以酪氨酸为底物通过酪氨酸解氨酶生成对香豆酸;再通过连续的羟基化、甲基化和还原反应生成咖啡酸、阿魏酸、松柏醇,最终得到松脂素[30].由于其他木脂素类化合物的合成路线目前尚未被报道,本节主要介绍芝麻素及其衍生物、亚麻木酚素的生物合成路径. ...
... 松脂素首先通过双功能的NADPH依赖型松脂素/落叶松脂素还原酶(PLR)转化为落叶松脂素和SECO(图5).von Heimendahl等[65]从L. album中分离出编码PLR的基因,通过异源表达证明其具备催化(+)-松脂素转化为(-)-SECO的能力.结合转录组和代谢产物分析发现菘蓝(Isatis indigotica)中liPLR1对落叶松脂素的合成至关重要,而且通过RNA干扰抑制liPLR1的表达显著影响落叶松脂素合成[51].拟南芥中的AtPLR对松脂素表现出严格的偏好性,而对落叶松脂素的偏好性较低甚至无活性,这和其他植物来源的PLR差异较大[10].底物偏好性分析表明,拟南芥松脂素还原酶1(AtPrR1)可以利用(±)-松脂素为底物,AtPrR2只能利用(-)-松脂素.此外,来源于亚麻的转录因子LuWRKY36通过其N端的WRKY域和LuPLR1启动子的W盒结合,上调LuPLR1的表达[66]. ...
Recent advances in research on lignans and neolignans
1
2016
... 芳基萘和芳基四氢萘类木脂素都具有显著的生物活性,受到制药工业的关注.其中,芳基萘木脂素是传统中药的成分,具有抗病毒、抗真菌、抗原生动物和抗血小板等活性[11],典型的芳基萘类木脂素包括山荷叶素和赛菊芋黄素;芳基四氢萘类木脂素在传统医学中被广泛用于各种疾病的治疗[12],鬼臼毒素和南烛木树脂酚是芳基四氢萘类木脂素的研究热点. ...
Advances in the synthesis of aryltetralin lignan lactones
1
2007
... 芳基萘和芳基四氢萘类木脂素都具有显著的生物活性,受到制药工业的关注.其中,芳基萘木脂素是传统中药的成分,具有抗病毒、抗真菌、抗原生动物和抗血小板等活性[11],典型的芳基萘类木脂素包括山荷叶素和赛菊芋黄素;芳基四氢萘类木脂素在传统医学中被广泛用于各种疾病的治疗[12],鬼臼毒素和南烛木树脂酚是芳基四氢萘类木脂素的研究热点. ...
Effects of diphyllin as a novel V-ATPase inhibitor on gastric adenocarcinoma
1
2011
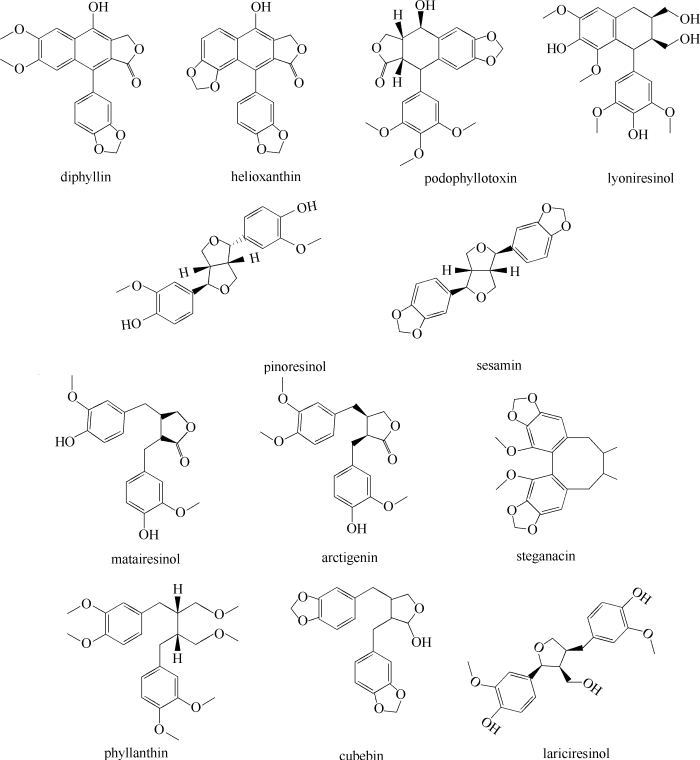
... 山荷叶素(diphyllin,图2)来源于丘生闭花木(Cleistanthus collinus),可以作为新型V-ATPase抑制剂来治疗胃癌,并且抑制Wnt /β-catenin信号传导中LRP6的磷酸化[13].山荷叶素能抑制食道癌细胞系TE-1和ECA-109的增殖和诱导S期阻滞;其还能通过调控mTORC1/HIF-1α-/VEGF途径阻碍血液转移[14].此外,山荷叶素还能诱导活性氧的产生来破坏沙门氏菌的生物膜[15]. ...
Effects of diphyllin as a novel V-ATPase inhibitor on TE-1 and ECA-109 cells
1
2018
... 山荷叶素(diphyllin,图2)来源于丘生闭花木(Cleistanthus collinus),可以作为新型V-ATPase抑制剂来治疗胃癌,并且抑制Wnt /β-catenin信号传导中LRP6的磷酸化[13].山荷叶素能抑制食道癌细胞系TE-1和ECA-109的增殖和诱导S期阻滞;其还能通过调控mTORC1/HIF-1α-/VEGF途径阻碍血液转移[14].此外,山荷叶素还能诱导活性氧的产生来破坏沙门氏菌的生物膜[15]. ...
Antibacterial and antibiofilm activities of diphyllin against fish pathogens
1
2020
... 山荷叶素(diphyllin,图2)来源于丘生闭花木(Cleistanthus collinus),可以作为新型V-ATPase抑制剂来治疗胃癌,并且抑制Wnt /β-catenin信号传导中LRP6的磷酸化[13].山荷叶素能抑制食道癌细胞系TE-1和ECA-109的增殖和诱导S期阻滞;其还能通过调控mTORC1/HIF-1α-/VEGF途径阻碍血液转移[14].此外,山荷叶素还能诱导活性氧的产生来破坏沙门氏菌的生物膜[15]. ...
Helioxanthin suppresses the cross talk of COX-2/PGE2 and EGFR/ERK pathway to inhibit Arecoline-induced Oral Cancer Cell (T28) proliferation and blocks tumor growth in xenografted nude mice
1
2016
... 赛菊芋黄素(helioxanthin)从台湾杉(Taiwania cryptomerioides Hayata)中分离得到.赛菊芋黄素能下调EGFR/ERK/c-fos信号通路抑制COX-2表达,激活p27诱导G2/M细胞周期阻滞,进而抑制口腔鳞状细胞癌细胞的增殖[16].赛菊芋黄素还能抑制脑肿瘤转移,阻止黑色素瘤和脑内皮细胞的迁移[17]. ...
The total synthesis of Retrojusticidin B, Justicidin E, and Helioxanthin
1
2015
... 赛菊芋黄素(helioxanthin)从台湾杉(Taiwania cryptomerioides Hayata)中分离得到.赛菊芋黄素能下调EGFR/ERK/c-fos信号通路抑制COX-2表达,激活p27诱导G2/M细胞周期阻滞,进而抑制口腔鳞状细胞癌细胞的增殖[16].赛菊芋黄素还能抑制脑肿瘤转移,阻止黑色素瘤和脑内皮细胞的迁移[17]. ...
Podophyllotoxin, a medicinal agent of plant origin: past, present and future
1
2012
... 鬼臼毒素(podophyllotoxin)从桃儿七(Podophyllum emodi Wall)和足叶草(Podophyllum peltatum L.)等鬼臼类植物中分离得到[18].它被用作很多著名的抗肿瘤药物的合成前体,包括依托泊苷(etoposide)、依托泊福(etopophos)和替尼泊甙(teniposide)[19].Bala等[20]发现鬼臼毒素在酿酒酵母中能抗辐射,为其他生物的抗辐射研究奠定了基础.Casey等[21]利用亚砜构建了简短的立体选择性鬼臼毒素全合成路径,利用一锅串联共轭加成/醛醇/亲电子芳族取代反应合成四氢化萘.Huang等[22]从桃儿七的根茎分离得到的内生菌TW5,发酵7 d后鬼臼毒素产量达到49.3 μg/g菌丝体干重. ...
Podophyllotoxin
1
2000
... 鬼臼毒素(podophyllotoxin)从桃儿七(Podophyllum emodi Wall)和足叶草(Podophyllum peltatum L.)等鬼臼类植物中分离得到[18].它被用作很多著名的抗肿瘤药物的合成前体,包括依托泊苷(etoposide)、依托泊福(etopophos)和替尼泊甙(teniposide)[19].Bala等[20]发现鬼臼毒素在酿酒酵母中能抗辐射,为其他生物的抗辐射研究奠定了基础.Casey等[21]利用亚砜构建了简短的立体选择性鬼臼毒素全合成路径,利用一锅串联共轭加成/醛醇/亲电子芳族取代反应合成四氢化萘.Huang等[22]从桃儿七的根茎分离得到的内生菌TW5,发酵7 d后鬼臼毒素产量达到49.3 μg/g菌丝体干重. ...
Radioprotective effect of podophyllotoxin in Saccharomyces cerevisiae
1
2004
... 鬼臼毒素(podophyllotoxin)从桃儿七(Podophyllum emodi Wall)和足叶草(Podophyllum peltatum L.)等鬼臼类植物中分离得到[18].它被用作很多著名的抗肿瘤药物的合成前体,包括依托泊苷(etoposide)、依托泊福(etopophos)和替尼泊甙(teniposide)[19].Bala等[20]发现鬼臼毒素在酿酒酵母中能抗辐射,为其他生物的抗辐射研究奠定了基础.Casey等[21]利用亚砜构建了简短的立体选择性鬼臼毒素全合成路径,利用一锅串联共轭加成/醛醇/亲电子芳族取代反应合成四氢化萘.Huang等[22]从桃儿七的根茎分离得到的内生菌TW5,发酵7 d后鬼臼毒素产量达到49.3 μg/g菌丝体干重. ...
A concise stereocontrolled formal total synthesis of (+/-)-podophyllotoxin using sulfoxide chemistry
1
2004
... 鬼臼毒素(podophyllotoxin)从桃儿七(Podophyllum emodi Wall)和足叶草(Podophyllum peltatum L.)等鬼臼类植物中分离得到[18].它被用作很多著名的抗肿瘤药物的合成前体,包括依托泊苷(etoposide)、依托泊福(etopophos)和替尼泊甙(teniposide)[19].Bala等[20]发现鬼臼毒素在酿酒酵母中能抗辐射,为其他生物的抗辐射研究奠定了基础.Casey等[21]利用亚砜构建了简短的立体选择性鬼臼毒素全合成路径,利用一锅串联共轭加成/醛醇/亲电子芳族取代反应合成四氢化萘.Huang等[22]从桃儿七的根茎分离得到的内生菌TW5,发酵7 d后鬼臼毒素产量达到49.3 μg/g菌丝体干重. ...
Mucor fragilis as a novel source of the key pharmaceutical agents podophyllotoxin and kaempferol
1
2014
... 鬼臼毒素(podophyllotoxin)从桃儿七(Podophyllum emodi Wall)和足叶草(Podophyllum peltatum L.)等鬼臼类植物中分离得到[18].它被用作很多著名的抗肿瘤药物的合成前体,包括依托泊苷(etoposide)、依托泊福(etopophos)和替尼泊甙(teniposide)[19].Bala等[20]发现鬼臼毒素在酿酒酵母中能抗辐射,为其他生物的抗辐射研究奠定了基础.Casey等[21]利用亚砜构建了简短的立体选择性鬼臼毒素全合成路径,利用一锅串联共轭加成/醛醇/亲电子芳族取代反应合成四氢化萘.Huang等[22]从桃儿七的根茎分离得到的内生菌TW5,发酵7 d后鬼臼毒素产量达到49.3 μg/g菌丝体干重. ...
Lyoniresinol inhibits melanogenic activity through the induction of microphthalmia-associated transcription factor and extracellular receptor kinase activation
1
2013
... 南烛木树脂酚(lyoniresinol)具有抗氧化和抗突变活性,能通过减少酪氨酸酶的蛋白表达和活性抑制黑色素生成[23].体内和体外实验均表明南烛木树脂酚可以在临床皮肤治疗中用作皮肤美白剂.南烛木树脂酚可以从一些植物中提取,小果南烛提取出的产物的旋光性最高[24].除了从植物提取外,还能通过纤维素酶水解南烛木树脂酚糖苷合成.Takemoto等[25]结合合成化学和植物细胞培养的方法合成南烛木树脂酚. ...
Stereochemistry and biosynthesis of (+)-lyoniresinol, a syringyl tetrahydronaphthalene lignan in Lyonia ovalifolia var. elliptica (I): Isolation and stereochemistry of syringyl lignans and predicted precursors to (+)-lyoniresinol from wood
1
2007
... 南烛木树脂酚(lyoniresinol)具有抗氧化和抗突变活性,能通过减少酪氨酸酶的蛋白表达和活性抑制黑色素生成[23].体内和体外实验均表明南烛木树脂酚可以在临床皮肤治疗中用作皮肤美白剂.南烛木树脂酚可以从一些植物中提取,小果南烛提取出的产物的旋光性最高[24].除了从植物提取外,还能通过纤维素酶水解南烛木树脂酚糖苷合成.Takemoto等[25]结合合成化学和植物细胞培养的方法合成南烛木树脂酚. ...
Synthesis of Lyoniresinol with combined utilization of synthetic chemistry and biotechnological methods
1
2006
... 南烛木树脂酚(lyoniresinol)具有抗氧化和抗突变活性,能通过减少酪氨酸酶的蛋白表达和活性抑制黑色素生成[23].体内和体外实验均表明南烛木树脂酚可以在临床皮肤治疗中用作皮肤美白剂.南烛木树脂酚可以从一些植物中提取,小果南烛提取出的产物的旋光性最高[24].除了从植物提取外,还能通过纤维素酶水解南烛木树脂酚糖苷合成.Takemoto等[25]结合合成化学和植物细胞培养的方法合成南烛木树脂酚. ...
Naturally occurring furofuran lignans: structural diversity and biological activities
1
2019
... 双并四氢呋喃类木脂素含有2,6-二芳基-3,7-二氧杂双环辛烷骨架,又被称为双环氧木脂素[26].连接方式、取代基和构型的不同造成双并四氢呋喃类木脂素的种类十分丰富.结构上的变化赋予了双并四氢呋喃类木脂素抗氧化、抗炎和抗菌活性,具有代表性的化合物包括松脂素和芝麻素. ...
Antibacterial activity and mechanism of pinoresinol from Cinnamomum Camphora leaves against food-related bacteria
1
2017
... 松脂素(pinoresinol)属于双并四氢呋喃类木脂素,在木本植物和纤维植物中含量较多.松脂素通过改变细胞的生理和形态,抑制大肠杆菌(Escherichia coli)、绿脓杆菌(Pseudomonas aeruginosa)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、肠道沙门氏菌(Salmonella enterica)的生长[27].从接骨木属植物(Sambucus williamsii)中分离出的松脂素表现出抗真菌特性,对人类红细胞不会造成影响[28].松脂素还能改善记忆障碍并促进海马LTP的诱导,这可能和松脂素对AChE和钙内流的影响有关[29]. ...
Antifungal effect of (+)-pinoresinol isolated from Sambucus williamsii
1
2010
... 松脂素(pinoresinol)属于双并四氢呋喃类木脂素,在木本植物和纤维植物中含量较多.松脂素通过改变细胞的生理和形态,抑制大肠杆菌(Escherichia coli)、绿脓杆菌(Pseudomonas aeruginosa)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、肠道沙门氏菌(Salmonella enterica)的生长[27].从接骨木属植物(Sambucus williamsii)中分离出的松脂素表现出抗真菌特性,对人类红细胞不会造成影响[28].松脂素还能改善记忆障碍并促进海马LTP的诱导,这可能和松脂素对AChE和钙内流的影响有关[29]. ...
The effects of pinoresinol on cholinergic dysfunction-induced memory impairments and synaptic plasticity in mice
1
2019
... 松脂素(pinoresinol)属于双并四氢呋喃类木脂素,在木本植物和纤维植物中含量较多.松脂素通过改变细胞的生理和形态,抑制大肠杆菌(Escherichia coli)、绿脓杆菌(Pseudomonas aeruginosa)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、肠道沙门氏菌(Salmonella enterica)的生长[27].从接骨木属植物(Sambucus williamsii)中分离出的松脂素表现出抗真菌特性,对人类红细胞不会造成影响[28].松脂素还能改善记忆障碍并促进海马LTP的诱导,这可能和松脂素对AChE和钙内流的影响有关[29]. ...
Sesame: bioactive compounds and health benefits
2
2017
... 芝麻素(sesamin)以松脂素为前体合成,是芝麻种子主要的双并四氢呋喃木脂素.芝麻油中的木脂素主要包括芝麻素(0.1%~0.6%)、芝麻林素(sesamolin,0.25%~0.3%)、芝麻酚(sesamol)和芝麻素酚(sesaminol),这些成分可以帮助细胞抵抗酸败[30].长期服用芝麻素酚被认为可以抑制和阿尔兹海默症相关的致病的胞外β-淀粉样蛋白聚集[31].它还可以被用作针对细胞周期蛋白D1过表达癌症的可能的抗癌药物[32]. ...
... 木脂素的生物合成引起了广泛关注,其原因包括:(1)木脂素的生物合成涉及独特的立体化学性质;(2)木脂素具有很多重要的临床生物活性;(3)木脂素及其衍生物,如去甲木脂素通过生物合成大量积累在树的心材区域 [10].苯丙氨酸和酪氨酸是单宁、木质素和木脂素合成的前体.苯丙氨酸通过苯丙氨酸解氨酶生成肉桂酸(图3),接着经过肉桂酸-4-羟化酶催化生成对香豆酸,或者以酪氨酸为底物通过酪氨酸解氨酶生成对香豆酸;再通过连续的羟基化、甲基化和还原反应生成咖啡酸、阿魏酸、松柏醇,最终得到松脂素[30].由于其他木脂素类化合物的合成路线目前尚未被报道,本节主要介绍芝麻素及其衍生物、亚麻木酚素的生物合成路径. ...
Effects of sesaminol feeding on brain Aβ accumulation in a senescence-accelerated mouse-prone 8
1
2016
... 芝麻素(sesamin)以松脂素为前体合成,是芝麻种子主要的双并四氢呋喃木脂素.芝麻油中的木脂素主要包括芝麻素(0.1%~0.6%)、芝麻林素(sesamolin,0.25%~0.3%)、芝麻酚(sesamol)和芝麻素酚(sesaminol),这些成分可以帮助细胞抵抗酸败[30].长期服用芝麻素酚被认为可以抑制和阿尔兹海默症相关的致病的胞外β-淀粉样蛋白聚集[31].它还可以被用作针对细胞周期蛋白D1过表达癌症的可能的抗癌药物[32]. ...
The pleiotropic regulation of cyclin D1 by newly identified sesaminol-binding protein ANT2
1
2017
... 芝麻素(sesamin)以松脂素为前体合成,是芝麻种子主要的双并四氢呋喃木脂素.芝麻油中的木脂素主要包括芝麻素(0.1%~0.6%)、芝麻林素(sesamolin,0.25%~0.3%)、芝麻酚(sesamol)和芝麻素酚(sesaminol),这些成分可以帮助细胞抵抗酸败[30].长期服用芝麻素酚被认为可以抑制和阿尔兹海默症相关的致病的胞外β-淀粉样蛋白聚集[31].它还可以被用作针对细胞周期蛋白D1过表达癌症的可能的抗癌药物[32]. ...
Pinoresinol and matairesinol accumulation in a Forsythia x intermedia cell suspension culture
1
2002
... 在过去二十年里,很多天然来源的双并四氢呋喃类木脂素被分离并鉴定出结构.虽然双并四氢呋喃类木脂素,例如松脂素可以从谷物、豆类、水果和蔬菜中分离,但是分离产物的效率和产量较低.在含有6%的蔗糖的培养基中,金钟连翘(Forsythia x intermedia)细胞悬浮培养(12±2)d后,(+)-松脂素的对映体含量达到75%±5%[33].随着芝麻素及其衍生物的路径被完全解析,人们可以尝试在微生物细胞工厂中异源合成芝麻素. ...
Optimum yields of dibenzylbutyrolactone-type lignans from cynareae fruits, during their ripening, germination and enzymatic hydrolysis processes, determined by on-line chromatographic methods
1
2012
... 二苄基丁内酯类木脂素及其糖苷类化合物和它们的生理特性密切相关,其具有抗肿瘤、抗病毒、神经保护和抗炎等重要作用.罗汉松脂素和牛蒡酚是重要的二苄基丁内酯类木脂素,均对癌细胞系表现出明显的细胞毒性[34]. ...
Immunomodulatory effect of (-)-matairesinol in vivo and ex vivo
1
2011
... 罗汉松脂素(matairesinol)属于二苄基丁内酯类木脂素,存在于多种种子、蔬菜和水果中,具有抗氧化、抗雌激素、抗骨质疏松等活性,能减少激素依赖型癌症的风险[35].Choi等[36]发现罗汉松脂素的抗骨质疏松活性主要通过p38/ERK-NFATc1信号通路表现,而不是抗吸收行为.在大鼠和人的尿液中,罗汉松脂素被肠道细菌转化为肠二醇和肠内酯.罗汉松脂素通过细胞周期阻滞和细胞凋亡,对急性淋巴细胞白血病CCRF-CEM细胞系产生细胞毒性[37].瑞香和芫花被证实是通过开环异落叶松脂素脱氢酶(SDH)催化合成(+)-罗汉松脂素[38].传统的阿魏酸的氧化偶联反应合成罗汉松脂素产量较低,Zhu等[39]利用区域选择性氧化偶联,以5-(叔丁基)-阿魏酸为前体合成罗汉松脂素,转化率高达91%. ...
Anti-osteoclastogenic activity of matairesinol via suppression of p38/ERK-NFATc1 signaling axis
1
2014
... 罗汉松脂素(matairesinol)属于二苄基丁内酯类木脂素,存在于多种种子、蔬菜和水果中,具有抗氧化、抗雌激素、抗骨质疏松等活性,能减少激素依赖型癌症的风险[35].Choi等[36]发现罗汉松脂素的抗骨质疏松活性主要通过p38/ERK-NFATc1信号通路表现,而不是抗吸收行为.在大鼠和人的尿液中,罗汉松脂素被肠道细菌转化为肠二醇和肠内酯.罗汉松脂素通过细胞周期阻滞和细胞凋亡,对急性淋巴细胞白血病CCRF-CEM细胞系产生细胞毒性[37].瑞香和芫花被证实是通过开环异落叶松脂素脱氢酶(SDH)催化合成(+)-罗汉松脂素[38].传统的阿魏酸的氧化偶联反应合成罗汉松脂素产量较低,Zhu等[39]利用区域选择性氧化偶联,以5-(叔丁基)-阿魏酸为前体合成罗汉松脂素,转化率高达91%. ...
Cytotoxicity of arctigenin and matairesinol against the T-cell lymphoma cell line CCRF-CEM
1
2015
... 罗汉松脂素(matairesinol)属于二苄基丁内酯类木脂素,存在于多种种子、蔬菜和水果中,具有抗氧化、抗雌激素、抗骨质疏松等活性,能减少激素依赖型癌症的风险[35].Choi等[36]发现罗汉松脂素的抗骨质疏松活性主要通过p38/ERK-NFATc1信号通路表现,而不是抗吸收行为.在大鼠和人的尿液中,罗汉松脂素被肠道细菌转化为肠二醇和肠内酯.罗汉松脂素通过细胞周期阻滞和细胞凋亡,对急性淋巴细胞白血病CCRF-CEM细胞系产生细胞毒性[37].瑞香和芫花被证实是通过开环异落叶松脂素脱氢酶(SDH)催化合成(+)-罗汉松脂素[38].传统的阿魏酸的氧化偶联反应合成罗汉松脂素产量较低,Zhu等[39]利用区域选择性氧化偶联,以5-(叔丁基)-阿魏酸为前体合成罗汉松脂素,转化率高达91%. ...
Stereochemistry of matairesinol formation by Daphne secoisolariciresinol dehydrogenase
2
2004
... 罗汉松脂素(matairesinol)属于二苄基丁内酯类木脂素,存在于多种种子、蔬菜和水果中,具有抗氧化、抗雌激素、抗骨质疏松等活性,能减少激素依赖型癌症的风险[35].Choi等[36]发现罗汉松脂素的抗骨质疏松活性主要通过p38/ERK-NFATc1信号通路表现,而不是抗吸收行为.在大鼠和人的尿液中,罗汉松脂素被肠道细菌转化为肠二醇和肠内酯.罗汉松脂素通过细胞周期阻滞和细胞凋亡,对急性淋巴细胞白血病CCRF-CEM细胞系产生细胞毒性[37].瑞香和芫花被证实是通过开环异落叶松脂素脱氢酶(SDH)催化合成(+)-罗汉松脂素[38].传统的阿魏酸的氧化偶联反应合成罗汉松脂素产量较低,Zhu等[39]利用区域选择性氧化偶联,以5-(叔丁基)-阿魏酸为前体合成罗汉松脂素,转化率高达91%. ...
... 罗汉松脂素被证实通过开环异落叶松脂素脱氢酶催化SECO的合成[38];然而,牛蒡酚的生物合成路径尚未解析,主要依赖于植物提取.天然的二苄基丁内酯类木脂素化合物及其衍生物为抗癌药物的研发和筛选提供了丰富的资源库. ...
Regioselective oxidative coupling approach to the synthesis of (+/-)-matairesinol and (+/-)-secoisolariciresinol
1
2006
... 罗汉松脂素(matairesinol)属于二苄基丁内酯类木脂素,存在于多种种子、蔬菜和水果中,具有抗氧化、抗雌激素、抗骨质疏松等活性,能减少激素依赖型癌症的风险[35].Choi等[36]发现罗汉松脂素的抗骨质疏松活性主要通过p38/ERK-NFATc1信号通路表现,而不是抗吸收行为.在大鼠和人的尿液中,罗汉松脂素被肠道细菌转化为肠二醇和肠内酯.罗汉松脂素通过细胞周期阻滞和细胞凋亡,对急性淋巴细胞白血病CCRF-CEM细胞系产生细胞毒性[37].瑞香和芫花被证实是通过开环异落叶松脂素脱氢酶(SDH)催化合成(+)-罗汉松脂素[38].传统的阿魏酸的氧化偶联反应合成罗汉松脂素产量较低,Zhu等[39]利用区域选择性氧化偶联,以5-(叔丁基)-阿魏酸为前体合成罗汉松脂素,转化率高达91%. ...
Arctigenin reduces blood pressure by modulation of nitric oxide synthase and NADPH oxidase expression in spontaneously hypertensive rats
1
2015
... 牛蒡酚(arctigenin)属于二苄基丁内酯类木脂素,分布于巴丹果、雪莲花、香榧和椰菜等,是牛蒡(Arctium lappa L.)种子的主要生物活性成分.利用牛蒡酚对原发性高血压大鼠进行长期治疗,可以明显降低收缩血压,改善大鼠的内皮功能障碍[40].牛蒡酚通过STAT3抑制作用增强癌细胞对顺铂的敏感性,促进顺铂诱导的癌细胞死亡[41].此外,牛蒡酚还可以穿过血脑屏障,在大脑中与海藻酸盐敏感的离子型谷氨酸受体相互作用[42].因此,牛蒡酚还能作为抑制谷氨酸诱发的中枢神经系统反应的潜在药物. ...
Arctigenin enhances chemosensitivity of cancer cells to cisplatin through inhibition of the STAT3 signaling pathway
1
2011
... 牛蒡酚(arctigenin)属于二苄基丁内酯类木脂素,分布于巴丹果、雪莲花、香榧和椰菜等,是牛蒡(Arctium lappa L.)种子的主要生物活性成分.利用牛蒡酚对原发性高血压大鼠进行长期治疗,可以明显降低收缩血压,改善大鼠的内皮功能障碍[40].牛蒡酚通过STAT3抑制作用增强癌细胞对顺铂的敏感性,促进顺铂诱导的癌细胞死亡[41].此外,牛蒡酚还可以穿过血脑屏障,在大脑中与海藻酸盐敏感的离子型谷氨酸受体相互作用[42].因此,牛蒡酚还能作为抑制谷氨酸诱发的中枢神经系统反应的潜在药物. ...
Arctigenin reduces neuronal responses in the somatosensory cortex via the inhibition of non-NMDA glutamate receptors
1
2016
... 牛蒡酚(arctigenin)属于二苄基丁内酯类木脂素,分布于巴丹果、雪莲花、香榧和椰菜等,是牛蒡(Arctium lappa L.)种子的主要生物活性成分.利用牛蒡酚对原发性高血压大鼠进行长期治疗,可以明显降低收缩血压,改善大鼠的内皮功能障碍[40].牛蒡酚通过STAT3抑制作用增强癌细胞对顺铂的敏感性,促进顺铂诱导的癌细胞死亡[41].此外,牛蒡酚还可以穿过血脑屏障,在大脑中与海藻酸盐敏感的离子型谷氨酸受体相互作用[42].因此,牛蒡酚还能作为抑制谷氨酸诱发的中枢神经系统反应的潜在药物. ...
Asymmetric synthesis of antimicrotubule biaryl hybrids of allocolchicine and steganacin
1
2007
... 五加前胡素(steganacin)属于天然的二苯并环辛二烯木脂素,于1973年从剑叶菊(Steganotaenia araliacea)中分离.与微管蛋白中的秋水仙碱位点结合后,五加前胡素在体内表现弱的抗肿瘤活性[43].五加前胡素的研究鲜有报道,目前尚未用于药物治疗.这可能是由于其结构复杂、合成难度大导致五加前胡素的产量极低.Augros等[44]报道了五加前胡素中间产物的无过渡金属的合成方式.五加前胡素的功能研究和药物应用有待于其生物合成路径的解析和化学合成法的探索. ...
Transition-metal-free synthesis of a known intermediate in the formal synthesis of (-)-steganacin
1
2017
... 五加前胡素(steganacin)属于天然的二苯并环辛二烯木脂素,于1973年从剑叶菊(Steganotaenia araliacea)中分离.与微管蛋白中的秋水仙碱位点结合后,五加前胡素在体内表现弱的抗肿瘤活性[43].五加前胡素的研究鲜有报道,目前尚未用于药物治疗.这可能是由于其结构复杂、合成难度大导致五加前胡素的产量极低.Augros等[44]报道了五加前胡素中间产物的无过渡金属的合成方式.五加前胡素的功能研究和药物应用有待于其生物合成路径的解析和化学合成法的探索. ...
Cytotoxic, caspase-3 induction and in vivo hepatoprotective effects of phyllanthin, a major constituent of Phyllanthus niruri
1
2015
... 叶下珠脂素(phyllanthin)属于二芳基丁烷类木脂素,从大戟科植物叶下珠(Phyllanthus amarus)中分离.Ooi等[45]发现叶下珠脂素通过诱导细胞凋亡抑制HepG2的细胞增殖.Lam等[46]构建了壳聚糖基微胶囊包裹叶下珠脂素,含有叶下珠脂素的微胶囊分别对人成纤维细胞与角质形成细胞、金黄色葡萄球菌表现出更高的抗氧化能力和生长抑制效果.Dunkoksung等[47]探究了叶下珠脂素穿过极化Caco-2的吸收能力和P-糖蛋白(P-gp)介导的药物互作中的潜在作用;叶下珠脂素能通过跨细胞途径被动扩散,干扰其他共同运输的药物的转运. ...
Development of phyllanthin containing microcapsules and their improved biological activity towards skin cells and Staphylococcus aureus
1
2012
... 叶下珠脂素(phyllanthin)属于二芳基丁烷类木脂素,从大戟科植物叶下珠(Phyllanthus amarus)中分离.Ooi等[45]发现叶下珠脂素通过诱导细胞凋亡抑制HepG2的细胞增殖.Lam等[46]构建了壳聚糖基微胶囊包裹叶下珠脂素,含有叶下珠脂素的微胶囊分别对人成纤维细胞与角质形成细胞、金黄色葡萄球菌表现出更高的抗氧化能力和生长抑制效果.Dunkoksung等[47]探究了叶下珠脂素穿过极化Caco-2的吸收能力和P-糖蛋白(P-gp)介导的药物互作中的潜在作用;叶下珠脂素能通过跨细胞途径被动扩散,干扰其他共同运输的药物的转运. ...
Potential p-glycoprotein-mediated herb-drug interaction of phyllanthin at the intestinal absorptive barrier
1
2019
... 叶下珠脂素(phyllanthin)属于二芳基丁烷类木脂素,从大戟科植物叶下珠(Phyllanthus amarus)中分离.Ooi等[45]发现叶下珠脂素通过诱导细胞凋亡抑制HepG2的细胞增殖.Lam等[46]构建了壳聚糖基微胶囊包裹叶下珠脂素,含有叶下珠脂素的微胶囊分别对人成纤维细胞与角质形成细胞、金黄色葡萄球菌表现出更高的抗氧化能力和生长抑制效果.Dunkoksung等[47]探究了叶下珠脂素穿过极化Caco-2的吸收能力和P-糖蛋白(P-gp)介导的药物互作中的潜在作用;叶下珠脂素能通过跨细胞途径被动扩散,干扰其他共同运输的药物的转运. ...
Cubebin, a lignan isolated from Aristolochia odoratissima L
1
2007
... 荜澄茄素(cubebin)属于二苄基丁酸乳酯类木脂素,分布在部分植物的木材、根和树脂,具有镇痛、消炎、抗锥虫的活性[48].荜澄茄素及其内酯和酰胺基衍生物具有显著的抗癌活性,Rajalekshmi等[49]通过体外实验检测了荜澄茄来源的(-)-荜澄茄素及其衍生物对6种人类癌细胞系(A549、K562、SiHa、KB、HCT116和HT29)的抗癌活性.在部分被测试细胞系中,酰胺基衍生物表现出更高的抗癌活性.Niwa等[50]研究了(-)-荜澄茄素对人肝癌细胞系的细胞毒性、致突变性和p38 MAP激酶与GSTa2的表达的影响,发现只有高浓度的荜澄茄素导致明显的细胞毒性. ...
Anticancer activity studies of cubebin isolated from Piper cubeba and its synthetic derivatives
1
2016
... 荜澄茄素(cubebin)属于二苄基丁酸乳酯类木脂素,分布在部分植物的木材、根和树脂,具有镇痛、消炎、抗锥虫的活性[48].荜澄茄素及其内酯和酰胺基衍生物具有显著的抗癌活性,Rajalekshmi等[49]通过体外实验检测了荜澄茄来源的(-)-荜澄茄素及其衍生物对6种人类癌细胞系(A549、K562、SiHa、KB、HCT116和HT29)的抗癌活性.在部分被测试细胞系中,酰胺基衍生物表现出更高的抗癌活性.Niwa等[50]研究了(-)-荜澄茄素对人肝癌细胞系的细胞毒性、致突变性和p38 MAP激酶与GSTa2的表达的影响,发现只有高浓度的荜澄茄素导致明显的细胞毒性. ...
Effects of (-)-cubebin (Piper cubeba) on cytotoxicity, mutagenicity and expression of p38 MAP kinase and GSTa2 in a hepatoma cell line
1
2013
... 荜澄茄素(cubebin)属于二苄基丁酸乳酯类木脂素,分布在部分植物的木材、根和树脂,具有镇痛、消炎、抗锥虫的活性[48].荜澄茄素及其内酯和酰胺基衍生物具有显著的抗癌活性,Rajalekshmi等[49]通过体外实验检测了荜澄茄来源的(-)-荜澄茄素及其衍生物对6种人类癌细胞系(A549、K562、SiHa、KB、HCT116和HT29)的抗癌活性.在部分被测试细胞系中,酰胺基衍生物表现出更高的抗癌活性.Niwa等[50]研究了(-)-荜澄茄素对人肝癌细胞系的细胞毒性、致突变性和p38 MAP激酶与GSTa2的表达的影响,发现只有高浓度的荜澄茄素导致明显的细胞毒性. ...
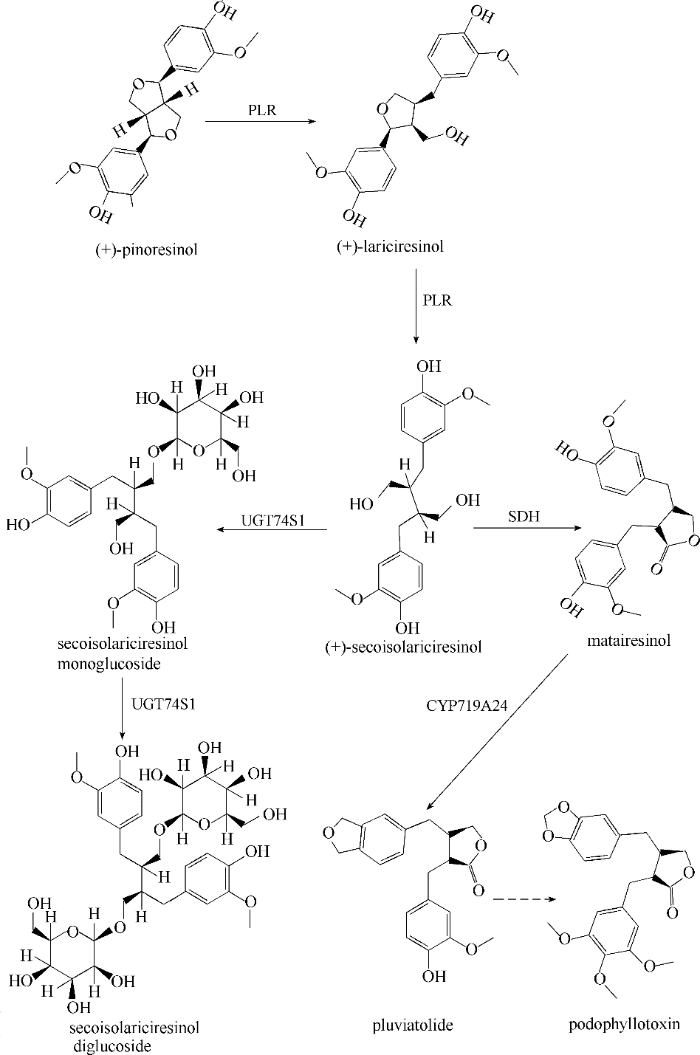
Combined transcriptome and metabolite profiling reveals that IiPLR1 plays an important role in lariciresinol accumulation in Isatis indigotica
2
2015
... 落叶松脂素(lariciresinol)属于呋喃类木脂素,具有抗菌、抗氧化、抗炎和抗雌激素等生物活性[51].Bajpai等[52]从菲律宾茜草(Rubia philippinensis)分离出落叶松脂素,检测其针对食源性病原体金黄色葡萄球菌KCTC1621和大肠杆菌O157∶H7的抗菌能力.通过最低抑菌浓度(MIC)实验发现,经过落叶松脂素处理的金黄色葡萄球菌KCTC1621和大肠杆菌O157∶H7的细胞壁形态遭到破坏.落叶松脂素还能破坏真菌质膜,抑制人类病原性真菌[53].此外,落叶松脂素可能通过激活线粒体介导的细胞凋亡途径抑制肝癌HepG2细胞[54]. ...
... 松脂素首先通过双功能的NADPH依赖型松脂素/落叶松脂素还原酶(PLR)转化为落叶松脂素和SECO(图5).von Heimendahl等[65]从L. album中分离出编码PLR的基因,通过异源表达证明其具备催化(+)-松脂素转化为(-)-SECO的能力.结合转录组和代谢产物分析发现菘蓝(Isatis indigotica)中liPLR1对落叶松脂素的合成至关重要,而且通过RNA干扰抑制liPLR1的表达显著影响落叶松脂素合成[51].拟南芥中的AtPLR对松脂素表现出严格的偏好性,而对落叶松脂素的偏好性较低甚至无活性,这和其他植物来源的PLR差异较大[10].底物偏好性分析表明,拟南芥松脂素还原酶1(AtPrR1)可以利用(±)-松脂素为底物,AtPrR2只能利用(-)-松脂素.此外,来源于亚麻的转录因子LuWRKY36通过其N端的WRKY域和LuPLR1启动子的W盒结合,上调LuPLR1的表达[66]. ...
Efficacy of (+)-lariciresinol to control bacterial growth of Staphylococcus aureus and Escherichia coli O157:H7
1
2017
... 落叶松脂素(lariciresinol)属于呋喃类木脂素,具有抗菌、抗氧化、抗炎和抗雌激素等生物活性[51].Bajpai等[52]从菲律宾茜草(Rubia philippinensis)分离出落叶松脂素,检测其针对食源性病原体金黄色葡萄球菌KCTC1621和大肠杆菌O157∶H7的抗菌能力.通过最低抑菌浓度(MIC)实验发现,经过落叶松脂素处理的金黄色葡萄球菌KCTC1621和大肠杆菌O157∶H7的细胞壁形态遭到破坏.落叶松脂素还能破坏真菌质膜,抑制人类病原性真菌[53].此外,落叶松脂素可能通过激活线粒体介导的细胞凋亡途径抑制肝癌HepG2细胞[54]. ...
Antifungal activity of lariciresinol derived from Sambucus williamsii and their membrane-active mechanisms in Candida albicans
1
2011
... 落叶松脂素(lariciresinol)属于呋喃类木脂素,具有抗菌、抗氧化、抗炎和抗雌激素等生物活性[51].Bajpai等[52]从菲律宾茜草(Rubia philippinensis)分离出落叶松脂素,检测其针对食源性病原体金黄色葡萄球菌KCTC1621和大肠杆菌O157∶H7的抗菌能力.通过最低抑菌浓度(MIC)实验发现,经过落叶松脂素处理的金黄色葡萄球菌KCTC1621和大肠杆菌O157∶H7的细胞壁形态遭到破坏.落叶松脂素还能破坏真菌质膜,抑制人类病原性真菌[53].此外,落叶松脂素可能通过激活线粒体介导的细胞凋亡途径抑制肝癌HepG2细胞[54]. ...
Lariciresinol induces apoptosis in HepG2 cells via mitochondrial-mediated apoptosis pathway
1
2018
... 落叶松脂素(lariciresinol)属于呋喃类木脂素,具有抗菌、抗氧化、抗炎和抗雌激素等生物活性[51].Bajpai等[52]从菲律宾茜草(Rubia philippinensis)分离出落叶松脂素,检测其针对食源性病原体金黄色葡萄球菌KCTC1621和大肠杆菌O157∶H7的抗菌能力.通过最低抑菌浓度(MIC)实验发现,经过落叶松脂素处理的金黄色葡萄球菌KCTC1621和大肠杆菌O157∶H7的细胞壁形态遭到破坏.落叶松脂素还能破坏真菌质膜,抑制人类病原性真菌[53].此外,落叶松脂素可能通过激活线粒体介导的细胞凋亡途径抑制肝癌HepG2细胞[54]. ...
Biotransformation of (-)-cubebin by Aspergillus spp. into (-)-hinokinin and (-)-parabenzlactone, and their evaluation against oral pathogenic bacteria
1
2018
... 除了落叶松脂素,其他木脂素类化合物的研究主要限制于植物来源的低丰度.目前,已经筛选到一些菌株可以实现木脂素的转化,例如(-)-荜澄茄素还能通过土曲霉(Aspergillus terreus)和黑曲霉(Aspergillus niger)转化为(-)-扁柏脂素和(-)-parabenzlactone,能显著抑制口腔病原菌[55];Xie等[56]从人的粪便中筛选得到粪肠球菌(Enterococcus faecalis)PDG-1,可以将(+)-松脂素转变为(+)-落叶松脂素.微生物合成法相比植物提取法,生产周期更短、产物浓度更高,是一种高效的生产替代方式.然而,大部分木脂素化合物的合成路径尚未解析,限制了微生物合成法的应用. ...
Biotransformation of pinoresinol diglucoside to mammalian lignans by human intestinal microflora, and isolation of Enterococcus faecalis strain PDG-1 responsible for the transformation of (+)-pinoresinol to (+)-lariciresinol
1
2003
... 除了落叶松脂素,其他木脂素类化合物的研究主要限制于植物来源的低丰度.目前,已经筛选到一些菌株可以实现木脂素的转化,例如(-)-荜澄茄素还能通过土曲霉(Aspergillus terreus)和黑曲霉(Aspergillus niger)转化为(-)-扁柏脂素和(-)-parabenzlactone,能显著抑制口腔病原菌[55];Xie等[56]从人的粪便中筛选得到粪肠球菌(Enterococcus faecalis)PDG-1,可以将(+)-松脂素转变为(+)-落叶松脂素.微生物合成法相比植物提取法,生产周期更短、产物浓度更高,是一种高效的生产替代方式.然而,大部分木脂素化合物的合成路径尚未解析,限制了微生物合成法的应用. ...
Formation of a methylenedioxy bridge in (+)-epipinoresinol by CYP81Q3 corroborates with diastereomeric specialization in sesame lignans
2
2018
... 芝麻(胡麻科,芝麻属)富含各种生物活性物质,包括木脂素、生育酚类似物、植物甾醇等.在芝麻种子里,两分子松脂素之间形成亚甲基二氧桥合成(+)-胡椒醇,再以相同的方式合成(+)-芝麻素.Ono等[8]发现芝麻中(+)-芝麻素和(+)-胡椒醇的合成(图4)都是经过CYP81Q1催化.经比较,CYP81Q1和同样催化亚甲二氧桥形成的CYP719A1的氨基酸序列一致性只有24%.CYP81Q1在芝麻中还存在两种同源蛋白,分别是S. radiatum来源的CYP81Q2和S. alatum来源的CYP81Q3.两种蛋白和CYP81Q1的结构相似,只有CYP81Q2和CYP81Q1表现出相同的NADPH依赖型胡椒醇合成酶活性.利用LC-MS检测S. alatum的木脂素组成,主要有(+)-2-episesalatin、(+)-alatumin和(+)-新木脂体柄果脂素[57].共表达CYP81Q3和细胞色素还原酶(CPR1)的酵母细胞,加入(+)-表松脂素,被彻底转化为(+)-新木脂体柄果脂素[57]. ...
... [57]. ...
Oxidative rearrangement of (+)-sesamin by CYP92B14 co-generates twin dietary lignans in sesame
3
2018
... 芝麻林素的合成需要在呋喃和苯环之间插入非典型氧[58],这个反应只在椭苞爵床(Justicia simplex)[59]和透骨草(Phryma leptostachya)中观察到[60].人们推测芝麻林素酚(sesamolinol)形成亚甲基二氧桥后转化为芝麻林素.收集表达CYP81Q1酿酒酵母的微粒体,与芝麻林素酚和NADPH混合,产物中没有检测到芝麻林素.Murata等[58]综合遗传、组学等方法鉴定了P450单加氧酶CYP92B14负责芝麻素加氧形成芝麻林素和芝麻素酚.以7R,7′S-samin为起始材料合成的呋喃木酚素和黄酮木酚素具有β-糖苷酶和自由基抑制活性.Tsai等[61]以芝麻林素为底物,通过酸催化合成了7R,7′S-samin;加入H2O2后,7R,7′S-samin转化为7R,7′R-samin. ...
... [58]综合遗传、组学等方法鉴定了P450单加氧酶CYP92B14负责芝麻素加氧形成芝麻林素和芝麻素酚.以7R,7′S-samin为起始材料合成的呋喃木酚素和黄酮木酚素具有β-糖苷酶和自由基抑制活性.Tsai等[61]以芝麻林素为底物,通过酸催化合成了7R,7′S-samin;加入H2O2后,7R,7′S-samin转化为7R,7′R-samin. ...
... 木脂素化合物的合成主要通过植物提取法,微生物法生产鲜有报道.木脂素化合物的研究集中在木脂素化合物的衍生化、药用价值和代谢路径的解析.芝麻素及其衍生物的关键酶在酿酒酵母和大肠杆菌中的功能鉴定为木脂素的微生物法生产奠定了基础.Ono等[8]在酵母INVsc中表达CYP81Q1后收集微粒体,并加入辅因子NADPH和(+)-松脂素,反应结束后通过HPLC检测到(+)-胡椒醇和(+)-芝麻素的生成.Murata等[58]从表达CYP92B14 和CPR1酵母细胞提取的微粒体,可以将芝麻素转化为芝麻林素和芝麻素酚.通过比较发现,当CYP92B14和CPR1共表达时,催化活性会显著提高;当CYP92B14单独表达时,只有微量的芝麻林素合成.以芝麻素为底物时,共表达CYP81Q1、CYP92B14和CPR1的酵母比单独表达CYP92B14和CPR1的细胞积累更多的芝麻林素和芝麻素酚,而且底物被完全消耗.另一方面,CYP81Q1不能单独作用于芝麻素,CYP92B14不能单独作用于松脂素和胡椒醇.CYP92B14和CYP81Q1在功能上的联系说明功能互作的酶类存在新的结构和功能的关系.Chandra等[80]在大肠杆菌中表达纯化CYP81Q1和CPR1用于芝麻素的体外合成.在CPR1存在的条件下,CYP81Q1催化松脂素合成芝麻素的能力大幅度提升.考虑到PLR或者是其他合成木脂素相关的细胞色素P450基因属于NADPH依赖型,还需要进一步提高细胞内NADPH/NADP+的比例[81-83],兼顾细胞生长和产物合成的平衡关系.此外,表达细胞色素P450时还需要筛选合适的CPR优化蛋白的表达水平[84]. ...
Simplexolin, a new lignan from Justicia simplex
1
1979
... 芝麻林素的合成需要在呋喃和苯环之间插入非典型氧[58],这个反应只在椭苞爵床(Justicia simplex)[59]和透骨草(Phryma leptostachya)中观察到[60].人们推测芝麻林素酚(sesamolinol)形成亚甲基二氧桥后转化为芝麻林素.收集表达CYP81Q1酿酒酵母的微粒体,与芝麻林素酚和NADPH混合,产物中没有检测到芝麻林素.Murata等[58]综合遗传、组学等方法鉴定了P450单加氧酶CYP92B14负责芝麻素加氧形成芝麻林素和芝麻素酚.以7R,7′S-samin为起始材料合成的呋喃木酚素和黄酮木酚素具有β-糖苷酶和自由基抑制活性.Tsai等[61]以芝麻林素为底物,通过酸催化合成了7R,7′S-samin;加入H2O2后,7R,7′S-samin转化为7R,7′R-samin. ...
Two new lignans from Phryma leptostachya L
1
2013
... 芝麻林素的合成需要在呋喃和苯环之间插入非典型氧[58],这个反应只在椭苞爵床(Justicia simplex)[59]和透骨草(Phryma leptostachya)中观察到[60].人们推测芝麻林素酚(sesamolinol)形成亚甲基二氧桥后转化为芝麻林素.收集表达CYP81Q1酿酒酵母的微粒体,与芝麻林素酚和NADPH混合,产物中没有检测到芝麻林素.Murata等[58]综合遗传、组学等方法鉴定了P450单加氧酶CYP92B14负责芝麻素加氧形成芝麻林素和芝麻素酚.以7R,7′S-samin为起始材料合成的呋喃木酚素和黄酮木酚素具有β-糖苷酶和自由基抑制活性.Tsai等[61]以芝麻林素为底物,通过酸催化合成了7R,7′S-samin;加入H2O2后,7R,7′S-samin转化为7R,7′R-samin. ...
Formation of samin diastereomers by acid-catalyzed transformation of sesamolin with hydrogen peroxide
1
2020
... 芝麻林素的合成需要在呋喃和苯环之间插入非典型氧[58],这个反应只在椭苞爵床(Justicia simplex)[59]和透骨草(Phryma leptostachya)中观察到[60].人们推测芝麻林素酚(sesamolinol)形成亚甲基二氧桥后转化为芝麻林素.收集表达CYP81Q1酿酒酵母的微粒体,与芝麻林素酚和NADPH混合,产物中没有检测到芝麻林素.Murata等[58]综合遗传、组学等方法鉴定了P450单加氧酶CYP92B14负责芝麻素加氧形成芝麻林素和芝麻素酚.以7R,7′S-samin为起始材料合成的呋喃木酚素和黄酮木酚素具有β-糖苷酶和自由基抑制活性.Tsai等[61]以芝麻林素为底物,通过酸催化合成了7R,7′S-samin;加入H2O2后,7R,7′S-samin转化为7R,7′R-samin. ...
Glycoside-specific glycosyltransferases catalyze regio-selective sequential glucosylations for a sesame lignan, sesaminol triglucoside
1
2020
... 芝麻素酚三糖苷合成的关键酶的鉴定过程困难,影响因素包括:(1)芝麻的遗传和基因组信息缺少;(2)大多数种子植物中的尿苷二磷酸(uridine diphosphate,UDP)-葡萄糖基转移酶和细胞色素P450的同源基因较多;(3)很多底物或者中间产物含量低,缺乏用于体外实验的商业化产品.Ono等[62]通过多维组学的方法找到了一种新的UDP-葡萄糖基转移酶,UGT94AG1可以催化芝麻素酚三糖苷的形成.通过酵母双杂实验还发现,UGT71A9、UGT94AG1和UGT94AA2与膜结合蛋白CYP81G1相互作用,完成三糖苷的合成. ...
Secoisolariciresinol diglucoside of flaxseed and its metabolites: biosynthesis and potential for nutraceuticals
1
2018
... 大部分木脂素以糖基化形式存在于植物中,比如前面提及的芝麻素酚三糖苷.亚麻木酚素,又称开环异落叶松脂素二葡萄糖苷(secoisolariciresinol diglucoside,SDG),属于亚麻籽中的糖基化木脂素.SDG具有保护机体免受心血管疾病、糖尿病、癌症和精神压力的影响的特性[63].SDG还能被转化为哺乳动物木脂素,具有作为抗癌药物的潜力[64]. ...
Flaxseed and human health: reviewing benefits and adverse effects
1
2012
... 大部分木脂素以糖基化形式存在于植物中,比如前面提及的芝麻素酚三糖苷.亚麻木酚素,又称开环异落叶松脂素二葡萄糖苷(secoisolariciresinol diglucoside,SDG),属于亚麻籽中的糖基化木脂素.SDG具有保护机体免受心血管疾病、糖尿病、癌症和精神压力的影响的特性[63].SDG还能被转化为哺乳动物木脂素,具有作为抗癌药物的潜力[64]. ...
Pinoresinol-lariciresinol reductases with different stereospecificity from Linum album and Linum usitatissimum
1
2005
... 松脂素首先通过双功能的NADPH依赖型松脂素/落叶松脂素还原酶(PLR)转化为落叶松脂素和SECO(图5).von Heimendahl等[65]从L. album中分离出编码PLR的基因,通过异源表达证明其具备催化(+)-松脂素转化为(-)-SECO的能力.结合转录组和代谢产物分析发现菘蓝(Isatis indigotica)中liPLR1对落叶松脂素的合成至关重要,而且通过RNA干扰抑制liPLR1的表达显著影响落叶松脂素合成[51].拟南芥中的AtPLR对松脂素表现出严格的偏好性,而对落叶松脂素的偏好性较低甚至无活性,这和其他植物来源的PLR差异较大[10].底物偏好性分析表明,拟南芥松脂素还原酶1(AtPrR1)可以利用(±)-松脂素为底物,AtPrR2只能利用(-)-松脂素.此外,来源于亚麻的转录因子LuWRKY36通过其N端的WRKY域和LuPLR1启动子的W盒结合,上调LuPLR1的表达[66]. ...
Characterization of LuWRKY36, a flax transcription factor promoting secoisolariciresinol biosynthesis in response to Fusarium oxysporum elicitors in Linum usitatissimum L. hairy roots
1
2019
... 松脂素首先通过双功能的NADPH依赖型松脂素/落叶松脂素还原酶(PLR)转化为落叶松脂素和SECO(图5).von Heimendahl等[65]从L. album中分离出编码PLR的基因,通过异源表达证明其具备催化(+)-松脂素转化为(-)-SECO的能力.结合转录组和代谢产物分析发现菘蓝(Isatis indigotica)中liPLR1对落叶松脂素的合成至关重要,而且通过RNA干扰抑制liPLR1的表达显著影响落叶松脂素合成[51].拟南芥中的AtPLR对松脂素表现出严格的偏好性,而对落叶松脂素的偏好性较低甚至无活性,这和其他植物来源的PLR差异较大[10].底物偏好性分析表明,拟南芥松脂素还原酶1(AtPrR1)可以利用(±)-松脂素为底物,AtPrR2只能利用(-)-松脂素.此外,来源于亚麻的转录因子LuWRKY36通过其N端的WRKY域和LuPLR1启动子的W盒结合,上调LuPLR1的表达[66]. ...
Biosynthetic pathway to the cancer chemopreventive secoisolariciresinol diglucoside-hydroxymethyl glutaryl ester-linked lignan oligomers in flax (Linum usitatissimum) seed
1
2002
... 亚麻籽中的木脂素主要以糖基化形式存在,表明体内存在有关的酶负责SECO的糖基化[67].植物的糖基转移酶是尿苷糖基转移酶(UGT),属于家族1糖基转移酶[68].Barvkar等[69]证明亚麻中存在137种UGT,并认为UGT74S1是催化种皮中SDG合成的SECO糖基转移酶.Ghose等[70]发现只有UGT74S1才能和UDP-葡萄糖反应合成开环异落叶松脂素单葡萄糖苷和SDG.Li等[71]从脱脂亚麻籽中分离和鉴定了可以在非严格厌氧条件下利用SDG合成SECO的菌株,转化效率超过80%. ...
A genome-wide phylogenetic reconstruction of family 1 UDP-glycosyltransferases revealed the expansion of the family during the adaptation of plants to life on land
1
2012
... 亚麻籽中的木脂素主要以糖基化形式存在,表明体内存在有关的酶负责SECO的糖基化[67].植物的糖基转移酶是尿苷糖基转移酶(UGT),属于家族1糖基转移酶[68].Barvkar等[69]证明亚麻中存在137种UGT,并认为UGT74S1是催化种皮中SDG合成的SECO糖基转移酶.Ghose等[70]发现只有UGT74S1才能和UDP-葡萄糖反应合成开环异落叶松脂素单葡萄糖苷和SDG.Li等[71]从脱脂亚麻籽中分离和鉴定了可以在非严格厌氧条件下利用SDG合成SECO的菌株,转化效率超过80%. ...
Phylogenomic analysis of UDP glycosyltransferase 1 multigene family in Linum usitatissimum identified genes with varied expression patterns
1
2012
... 亚麻籽中的木脂素主要以糖基化形式存在,表明体内存在有关的酶负责SECO的糖基化[67].植物的糖基转移酶是尿苷糖基转移酶(UGT),属于家族1糖基转移酶[68].Barvkar等[69]证明亚麻中存在137种UGT,并认为UGT74S1是催化种皮中SDG合成的SECO糖基转移酶.Ghose等[70]发现只有UGT74S1才能和UDP-葡萄糖反应合成开环异落叶松脂素单葡萄糖苷和SDG.Li等[71]从脱脂亚麻籽中分离和鉴定了可以在非严格厌氧条件下利用SDG合成SECO的菌株,转化效率超过80%. ...
Identification and functional characterization of a flax UDP-glycosyltransferase glucosylating secoisolariciresinol (SECO) into secoisolariciresinol monoglucoside (SMG) and diglucoside (SDG)
1
2014
... 亚麻籽中的木脂素主要以糖基化形式存在,表明体内存在有关的酶负责SECO的糖基化[67].植物的糖基转移酶是尿苷糖基转移酶(UGT),属于家族1糖基转移酶[68].Barvkar等[69]证明亚麻中存在137种UGT,并认为UGT74S1是催化种皮中SDG合成的SECO糖基转移酶.Ghose等[70]发现只有UGT74S1才能和UDP-葡萄糖反应合成开环异落叶松脂素单葡萄糖苷和SDG.Li等[71]从脱脂亚麻籽中分离和鉴定了可以在非严格厌氧条件下利用SDG合成SECO的菌株,转化效率超过80%. ...
Production of secoisolariciresinol from defatted flaxseed by bacterial biotransformation
1
2012
... 亚麻籽中的木脂素主要以糖基化形式存在,表明体内存在有关的酶负责SECO的糖基化[67].植物的糖基转移酶是尿苷糖基转移酶(UGT),属于家族1糖基转移酶[68].Barvkar等[69]证明亚麻中存在137种UGT,并认为UGT74S1是催化种皮中SDG合成的SECO糖基转移酶.Ghose等[70]发现只有UGT74S1才能和UDP-葡萄糖反应合成开环异落叶松脂素单葡萄糖苷和SDG.Li等[71]从脱脂亚麻籽中分离和鉴定了可以在非严格厌氧条件下利用SDG合成SECO的菌株,转化效率超过80%. ...
Complete biosynthesis of cannabinoids and their unnatural analogues in yeast
1
2020
... 微生物法生产植物天然产物具有很多优点,包括:(1)根据微生物细胞合成能力按需合成产品;(2)发酵工艺可以放大并且易于控制;(3)能合成比天然植物宿主纯度和产量更高的植物天然产物及其中间代谢产物[3].近年来,天然产物合成得到迅猛发展,比如利用酿酒酵母实现了大麻素和非天然结构类似物的从头合成[72],利用大肠杆菌成功合成紫杉醇前体紫杉二烯[73]和紫杉二烯氧化产物[74].目前,松柏醇和松脂素的微生物法生产为复杂的木脂素化合物的生物合成奠定了良好的基础. ...
Isoprenoid pathway optimization for taxol precursor overproduction in Escherichia coli
1
2010
... 微生物法生产植物天然产物具有很多优点,包括:(1)根据微生物细胞合成能力按需合成产品;(2)发酵工艺可以放大并且易于控制;(3)能合成比天然植物宿主纯度和产量更高的植物天然产物及其中间代谢产物[3].近年来,天然产物合成得到迅猛发展,比如利用酿酒酵母实现了大麻素和非天然结构类似物的从头合成[72],利用大肠杆菌成功合成紫杉醇前体紫杉二烯[73]和紫杉二烯氧化产物[74].目前,松柏醇和松脂素的微生物法生产为复杂的木脂素化合物的生物合成奠定了良好的基础. ...
Overcoming heterologous protein interdependency to optimize P450-mediated Taxol precursor synthesis in Escherichia coli
1
2016
... 微生物法生产植物天然产物具有很多优点,包括:(1)根据微生物细胞合成能力按需合成产品;(2)发酵工艺可以放大并且易于控制;(3)能合成比天然植物宿主纯度和产量更高的植物天然产物及其中间代谢产物[3].近年来,天然产物合成得到迅猛发展,比如利用酿酒酵母实现了大麻素和非天然结构类似物的从头合成[72],利用大肠杆菌成功合成紫杉醇前体紫杉二烯[73]和紫杉二烯氧化产物[74].目前,松柏醇和松脂素的微生物法生产为复杂的木脂素化合物的生物合成奠定了良好的基础. ...
Microbial production of natural and unnatural monolignols with Escherichia coli
1
2019
... 利用微生物法生产松柏醇反应条件温和,合成产物的专一性高,具体方法包括酶法合成和从头合成.Lv等[4]以廉价的丁香酚为底物,在大肠杆菌体内表达简青霉来源的香草醇氧化酶PsVAO合成松柏醇.PsVAO在催化过程释放有害副产物H2O2,过量的H2O2积累会导致PsVAO的活性受到抑制和细胞毒性.因为过氧化氢酶具备高过氧化氢酶活性和低过氧化物酶活性,所以选择将不同来源的过氧化氢酶引入生物转化系统.通过过氧化氢酶原位消除H2O2能解除H2O2对PsVAO的限制、提高松柏醇产量和防止松柏醇过度氧化.最终,松柏醇的产量为22.9 g/L,转化率为78.7%.Aschenbrenner等[75]在大肠杆菌体内构建了木质素单体的合成路径,加入2.5 mmol/L阿魏酸后,可以得到1.82 mmol/L松柏醇,远高于其他肉桂酸衍生物的转化效率.Chen等[5]根据植物体内松柏醇合成路径在大肠杆菌体内组合表达了TAL、4CL1、CCR和ADH实现对香豆醇的合成.然后,采用活性更高的HpaBC替代植物来源的C3H催化对香豆醇向咖啡醇的转化.考虑到HpaBC偏好以对香豆醇为底物,在发酵过程中优先积累对香豆醇.最终采用微生物共培养在大肠杆菌中重构松柏醇的从头合成路径,在2.5 L生物反应器上放大生产得到(124.9 ± 5.1) mg/L松柏醇和(232.9 ± 15.1) mg/L咖啡醇.Yang等[7]在酿酒酵母中从头合成松柏醇时,选择首先合成阿魏酸,通过将AtCOMT1、PaHpaB和EcHpaC整合到Ty4位点后,再共表达At4CL5、AtCAD5和AtCCR1,并结合NADPH的强化过表达zwf1和TYR1,松柏醇在摇瓶水平的积累量46.6 mg/L.在5 L生物反应器中放大生产,酿酒酵母最终积累201.1 mg/L松柏醇.酶法合成能够获得较高的松柏醇产量和底物转化效率;从头合成为工程菌株工业化生产提供了可能性. ...
Two-step one-pot synthesis of pinoresinol from eugenol in an enzymatic cascade
1
2015
... 在植物体内,两分子松柏醇通过同化蛋白的催化生成松脂素.松柏醇的高效微生物合成为松脂素合成奠定了基础.目前,松脂素的合成以酶法生产为主.酶催化中通过级联反应实现产物的一步合成具有很多优势,包括省时、省力、简化多步反应,避免中间产物的分离和纯化.Ricklefs等[76]构建了香草醇氧化酶和漆酶偶联的两步一锅法,利用丁香酚通过以松柏醇为中间产物合成松脂素.首先通过简青霉来源的香草醇氧化酶PsVAO和不同类型的细菌来源的漆酶共表达筛选最佳的合成松脂素的组合.再通过发酵条件的优化,松脂素最高产量达到1.6 g/L.在前期酶催化的基础上,Ricklefs等[77]构建了三步一锅法,利用全细胞催化合成了ee值高达98%的(+)-松脂素,通过表达金钟连翘来源的松脂素/落叶松脂素还原酶(FiPLR)获得了ee值高达97%的(+)-松脂素.Lv等[6]在体内构建了PsVAO和过氧化物酶共表达的体内H2O2自消除的松柏醇合成体系.为了平衡代谢流,PsVAO和过氧化物酶采用不同的连接方式进行表达.通过发酵条件的优化,松脂素的产量达到11.29 g/L,转化率为52.77%.在大肠杆菌中表达的过氧化物酶大部分属于apo-蛋白,培养基中添加适量的5-氨基乙酰丙酸可以增加全蛋白的合成[78].因此,增加大肠杆菌胞内血红素合成可以提高过氧化物酶的活性.令人意外的是,在大肠杆菌体内表达不同拷贝数的hemA和hemL基因时,松脂素的产量均下降.利用过氧化物酶偶联PsVAO合成松脂素的过程还需要考虑从其他角度优化代谢过程,比如阻断血红素降解途径[79]增加血红素和过氧化物酶的结合,进一步提高丁香酚向松脂素的转化效率. ...
Three-steps in one-pot: whole-cell biocatalytic synthesis of enantiopure (+)- and (-)-pinoresinol via kinetic resolution
1
2016
... 在植物体内,两分子松柏醇通过同化蛋白的催化生成松脂素.松柏醇的高效微生物合成为松脂素合成奠定了基础.目前,松脂素的合成以酶法生产为主.酶催化中通过级联反应实现产物的一步合成具有很多优势,包括省时、省力、简化多步反应,避免中间产物的分离和纯化.Ricklefs等[76]构建了香草醇氧化酶和漆酶偶联的两步一锅法,利用丁香酚通过以松柏醇为中间产物合成松脂素.首先通过简青霉来源的香草醇氧化酶PsVAO和不同类型的细菌来源的漆酶共表达筛选最佳的合成松脂素的组合.再通过发酵条件的优化,松脂素最高产量达到1.6 g/L.在前期酶催化的基础上,Ricklefs等[77]构建了三步一锅法,利用全细胞催化合成了ee值高达98%的(+)-松脂素,通过表达金钟连翘来源的松脂素/落叶松脂素还原酶(FiPLR)获得了ee值高达97%的(+)-松脂素.Lv等[6]在体内构建了PsVAO和过氧化物酶共表达的体内H2O2自消除的松柏醇合成体系.为了平衡代谢流,PsVAO和过氧化物酶采用不同的连接方式进行表达.通过发酵条件的优化,松脂素的产量达到11.29 g/L,转化率为52.77%.在大肠杆菌中表达的过氧化物酶大部分属于apo-蛋白,培养基中添加适量的5-氨基乙酰丙酸可以增加全蛋白的合成[78].因此,增加大肠杆菌胞内血红素合成可以提高过氧化物酶的活性.令人意外的是,在大肠杆菌体内表达不同拷贝数的hemA和hemL基因时,松脂素的产量均下降.利用过氧化物酶偶联PsVAO合成松脂素的过程还需要考虑从其他角度优化代谢过程,比如阻断血红素降解途径[79]增加血红素和过氧化物酶的结合,进一步提高丁香酚向松脂素的转化效率. ...
Heterologous expression and characterization of soybean cytosolic ascorbate peroxidase
1
1996
... 在植物体内,两分子松柏醇通过同化蛋白的催化生成松脂素.松柏醇的高效微生物合成为松脂素合成奠定了基础.目前,松脂素的合成以酶法生产为主.酶催化中通过级联反应实现产物的一步合成具有很多优势,包括省时、省力、简化多步反应,避免中间产物的分离和纯化.Ricklefs等[76]构建了香草醇氧化酶和漆酶偶联的两步一锅法,利用丁香酚通过以松柏醇为中间产物合成松脂素.首先通过简青霉来源的香草醇氧化酶PsVAO和不同类型的细菌来源的漆酶共表达筛选最佳的合成松脂素的组合.再通过发酵条件的优化,松脂素最高产量达到1.6 g/L.在前期酶催化的基础上,Ricklefs等[77]构建了三步一锅法,利用全细胞催化合成了ee值高达98%的(+)-松脂素,通过表达金钟连翘来源的松脂素/落叶松脂素还原酶(FiPLR)获得了ee值高达97%的(+)-松脂素.Lv等[6]在体内构建了PsVAO和过氧化物酶共表达的体内H2O2自消除的松柏醇合成体系.为了平衡代谢流,PsVAO和过氧化物酶采用不同的连接方式进行表达.通过发酵条件的优化,松脂素的产量达到11.29 g/L,转化率为52.77%.在大肠杆菌中表达的过氧化物酶大部分属于apo-蛋白,培养基中添加适量的5-氨基乙酰丙酸可以增加全蛋白的合成[78].因此,增加大肠杆菌胞内血红素合成可以提高过氧化物酶的活性.令人意外的是,在大肠杆菌体内表达不同拷贝数的hemA和hemL基因时,松脂素的产量均下降.利用过氧化物酶偶联PsVAO合成松脂素的过程还需要考虑从其他角度优化代谢过程,比如阻断血红素降解途径[79]增加血红素和过氧化物酶的结合,进一步提高丁香酚向松脂素的转化效率. ...
Metabolic engineering of Escherichia coli for secretory production of free haem
1
2018
... 在植物体内,两分子松柏醇通过同化蛋白的催化生成松脂素.松柏醇的高效微生物合成为松脂素合成奠定了基础.目前,松脂素的合成以酶法生产为主.酶催化中通过级联反应实现产物的一步合成具有很多优势,包括省时、省力、简化多步反应,避免中间产物的分离和纯化.Ricklefs等[76]构建了香草醇氧化酶和漆酶偶联的两步一锅法,利用丁香酚通过以松柏醇为中间产物合成松脂素.首先通过简青霉来源的香草醇氧化酶PsVAO和不同类型的细菌来源的漆酶共表达筛选最佳的合成松脂素的组合.再通过发酵条件的优化,松脂素最高产量达到1.6 g/L.在前期酶催化的基础上,Ricklefs等[77]构建了三步一锅法,利用全细胞催化合成了ee值高达98%的(+)-松脂素,通过表达金钟连翘来源的松脂素/落叶松脂素还原酶(FiPLR)获得了ee值高达97%的(+)-松脂素.Lv等[6]在体内构建了PsVAO和过氧化物酶共表达的体内H2O2自消除的松柏醇合成体系.为了平衡代谢流,PsVAO和过氧化物酶采用不同的连接方式进行表达.通过发酵条件的优化,松脂素的产量达到11.29 g/L,转化率为52.77%.在大肠杆菌中表达的过氧化物酶大部分属于apo-蛋白,培养基中添加适量的5-氨基乙酰丙酸可以增加全蛋白的合成[78].因此,增加大肠杆菌胞内血红素合成可以提高过氧化物酶的活性.令人意外的是,在大肠杆菌体内表达不同拷贝数的hemA和hemL基因时,松脂素的产量均下降.利用过氧化物酶偶联PsVAO合成松脂素的过程还需要考虑从其他角度优化代谢过程,比如阻断血红素降解途径[79]增加血红素和过氧化物酶的结合,进一步提高丁香酚向松脂素的转化效率. ...
Gene isolation, heterologous expression, purification and functional confirmation of sesamin synthase from Sesamum indicum L
1
2019
... 木脂素化合物的合成主要通过植物提取法,微生物法生产鲜有报道.木脂素化合物的研究集中在木脂素化合物的衍生化、药用价值和代谢路径的解析.芝麻素及其衍生物的关键酶在酿酒酵母和大肠杆菌中的功能鉴定为木脂素的微生物法生产奠定了基础.Ono等[8]在酵母INVsc中表达CYP81Q1后收集微粒体,并加入辅因子NADPH和(+)-松脂素,反应结束后通过HPLC检测到(+)-胡椒醇和(+)-芝麻素的生成.Murata等[58]从表达CYP92B14 和CPR1酵母细胞提取的微粒体,可以将芝麻素转化为芝麻林素和芝麻素酚.通过比较发现,当CYP92B14和CPR1共表达时,催化活性会显著提高;当CYP92B14单独表达时,只有微量的芝麻林素合成.以芝麻素为底物时,共表达CYP81Q1、CYP92B14和CPR1的酵母比单独表达CYP92B14和CPR1的细胞积累更多的芝麻林素和芝麻素酚,而且底物被完全消耗.另一方面,CYP81Q1不能单独作用于芝麻素,CYP92B14不能单独作用于松脂素和胡椒醇.CYP92B14和CYP81Q1在功能上的联系说明功能互作的酶类存在新的结构和功能的关系.Chandra等[80]在大肠杆菌中表达纯化CYP81Q1和CPR1用于芝麻素的体外合成.在CPR1存在的条件下,CYP81Q1催化松脂素合成芝麻素的能力大幅度提升.考虑到PLR或者是其他合成木脂素相关的细胞色素P450基因属于NADPH依赖型,还需要进一步提高细胞内NADPH/NADP+的比例[81-83],兼顾细胞生长和产物合成的平衡关系.此外,表达细胞色素P450时还需要筛选合适的CPR优化蛋白的表达水平[84]. ...
Improving NADPH availability for natural product biosynthesis in Escherichia coli by metabolic engineering
1
2010
... 木脂素化合物的合成主要通过植物提取法,微生物法生产鲜有报道.木脂素化合物的研究集中在木脂素化合物的衍生化、药用价值和代谢路径的解析.芝麻素及其衍生物的关键酶在酿酒酵母和大肠杆菌中的功能鉴定为木脂素的微生物法生产奠定了基础.Ono等[8]在酵母INVsc中表达CYP81Q1后收集微粒体,并加入辅因子NADPH和(+)-松脂素,反应结束后通过HPLC检测到(+)-胡椒醇和(+)-芝麻素的生成.Murata等[58]从表达CYP92B14 和CPR1酵母细胞提取的微粒体,可以将芝麻素转化为芝麻林素和芝麻素酚.通过比较发现,当CYP92B14和CPR1共表达时,催化活性会显著提高;当CYP92B14单独表达时,只有微量的芝麻林素合成.以芝麻素为底物时,共表达CYP81Q1、CYP92B14和CPR1的酵母比单独表达CYP92B14和CPR1的细胞积累更多的芝麻林素和芝麻素酚,而且底物被完全消耗.另一方面,CYP81Q1不能单独作用于芝麻素,CYP92B14不能单独作用于松脂素和胡椒醇.CYP92B14和CYP81Q1在功能上的联系说明功能互作的酶类存在新的结构和功能的关系.Chandra等[80]在大肠杆菌中表达纯化CYP81Q1和CPR1用于芝麻素的体外合成.在CPR1存在的条件下,CYP81Q1催化松脂素合成芝麻素的能力大幅度提升.考虑到PLR或者是其他合成木脂素相关的细胞色素P450基因属于NADPH依赖型,还需要进一步提高细胞内NADPH/NADP+的比例[81-83],兼顾细胞生长和产物合成的平衡关系.此外,表达细胞色素P450时还需要筛选合适的CPR优化蛋白的表达水平[84]. ...
Identification and circumvention of bottlenecks in CYP21A2-mediated premedrol production using recombinant Escherichia coli
2020
Production of 3-hydroxypropionate using a novel malonyl-CoA-mediated biosynthetic pathway in genetically engineered E. coli strain
1
2019
... 木脂素化合物的合成主要通过植物提取法,微生物法生产鲜有报道.木脂素化合物的研究集中在木脂素化合物的衍生化、药用价值和代谢路径的解析.芝麻素及其衍生物的关键酶在酿酒酵母和大肠杆菌中的功能鉴定为木脂素的微生物法生产奠定了基础.Ono等[8]在酵母INVsc中表达CYP81Q1后收集微粒体,并加入辅因子NADPH和(+)-松脂素,反应结束后通过HPLC检测到(+)-胡椒醇和(+)-芝麻素的生成.Murata等[58]从表达CYP92B14 和CPR1酵母细胞提取的微粒体,可以将芝麻素转化为芝麻林素和芝麻素酚.通过比较发现,当CYP92B14和CPR1共表达时,催化活性会显著提高;当CYP92B14单独表达时,只有微量的芝麻林素合成.以芝麻素为底物时,共表达CYP81Q1、CYP92B14和CPR1的酵母比单独表达CYP92B14和CPR1的细胞积累更多的芝麻林素和芝麻素酚,而且底物被完全消耗.另一方面,CYP81Q1不能单独作用于芝麻素,CYP92B14不能单独作用于松脂素和胡椒醇.CYP92B14和CYP81Q1在功能上的联系说明功能互作的酶类存在新的结构和功能的关系.Chandra等[80]在大肠杆菌中表达纯化CYP81Q1和CPR1用于芝麻素的体外合成.在CPR1存在的条件下,CYP81Q1催化松脂素合成芝麻素的能力大幅度提升.考虑到PLR或者是其他合成木脂素相关的细胞色素P450基因属于NADPH依赖型,还需要进一步提高细胞内NADPH/NADP+的比例[81-83],兼顾细胞生长和产物合成的平衡关系.此外,表达细胞色素P450时还需要筛选合适的CPR优化蛋白的表达水平[84]. ...
Controlling chemo- and regioselectivity of a plant P450 in yeast cell toward rare licorice triterpenoid biosynthesis
1
2020
... 木脂素化合物的合成主要通过植物提取法,微生物法生产鲜有报道.木脂素化合物的研究集中在木脂素化合物的衍生化、药用价值和代谢路径的解析.芝麻素及其衍生物的关键酶在酿酒酵母和大肠杆菌中的功能鉴定为木脂素的微生物法生产奠定了基础.Ono等[8]在酵母INVsc中表达CYP81Q1后收集微粒体,并加入辅因子NADPH和(+)-松脂素,反应结束后通过HPLC检测到(+)-胡椒醇和(+)-芝麻素的生成.Murata等[58]从表达CYP92B14 和CPR1酵母细胞提取的微粒体,可以将芝麻素转化为芝麻林素和芝麻素酚.通过比较发现,当CYP92B14和CPR1共表达时,催化活性会显著提高;当CYP92B14单独表达时,只有微量的芝麻林素合成.以芝麻素为底物时,共表达CYP81Q1、CYP92B14和CPR1的酵母比单独表达CYP92B14和CPR1的细胞积累更多的芝麻林素和芝麻素酚,而且底物被完全消耗.另一方面,CYP81Q1不能单独作用于芝麻素,CYP92B14不能单独作用于松脂素和胡椒醇.CYP92B14和CYP81Q1在功能上的联系说明功能互作的酶类存在新的结构和功能的关系.Chandra等[80]在大肠杆菌中表达纯化CYP81Q1和CPR1用于芝麻素的体外合成.在CPR1存在的条件下,CYP81Q1催化松脂素合成芝麻素的能力大幅度提升.考虑到PLR或者是其他合成木脂素相关的细胞色素P450基因属于NADPH依赖型,还需要进一步提高细胞内NADPH/NADP+的比例[81-83],兼顾细胞生长和产物合成的平衡关系.此外,表达细胞色素P450时还需要筛选合适的CPR优化蛋白的表达水平[84]. ...
Bioconversion of pinoresinol into matairesinol by use of recombinant Escherichia coli
1
2014
... 目前,能用于植物法提取鬼臼毒素的植物种类稀少,包括桃儿七、足叶草的根茎.由于植物生长缓慢,而鬼臼毒素的需求量大,人们尝试通过多种化学合成的方法生产鬼臼毒素.但是,化学合成法的产量低、成本高,不足以实现鬼臼毒素的商业化生产.鬼臼毒素的生物合成路径未被完全解析,无法在微生物体内实现鬼臼毒素的异源合成.在植物体内,松脂素通过PLR催化连续转化为落叶松脂素和SECO,SECO通过SDH催化生成罗汉松脂素,罗汉松脂素经过一些尚未鉴定的步骤最终合成鬼臼毒素.Kuo等[85]通过构建PLR和SDH的融合蛋白并在大肠杆菌中表达,以松脂素为底物合成罗汉松脂素(图5)的转化率能达到49.8%.从足叶草的根茎中分离出的内生真菌Phialocephala podophylli(菌株PPE7)在肉汤培养基中生长,能积累可检测的鬼臼毒素.Arneaud等[86]从PPE7基因组中克隆得到编码SDH的基因,在毕赤酵母(Pichia pastoris)体内成功实现SDH的异源表达,并检测到罗汉松脂素的生成.Marques等[87]对桃儿七和足叶草进行了转录组测序和生物信息学分析,分别筛选到了负责催化pluviatolide生成的 CYP719A23和CYP719A24.这种策略有利于鬼臼毒素后续反应的关键酶的鉴定,也为其他复杂木脂素化合物合成路径的解析提供参考. ...
Investigation and expression of the secoisolariciresinol dehydrogenase gene involved in podophyllotoxin biosynthesis
1
2015
... 目前,能用于植物法提取鬼臼毒素的植物种类稀少,包括桃儿七、足叶草的根茎.由于植物生长缓慢,而鬼臼毒素的需求量大,人们尝试通过多种化学合成的方法生产鬼臼毒素.但是,化学合成法的产量低、成本高,不足以实现鬼臼毒素的商业化生产.鬼臼毒素的生物合成路径未被完全解析,无法在微生物体内实现鬼臼毒素的异源合成.在植物体内,松脂素通过PLR催化连续转化为落叶松脂素和SECO,SECO通过SDH催化生成罗汉松脂素,罗汉松脂素经过一些尚未鉴定的步骤最终合成鬼臼毒素.Kuo等[85]通过构建PLR和SDH的融合蛋白并在大肠杆菌中表达,以松脂素为底物合成罗汉松脂素(图5)的转化率能达到49.8%.从足叶草的根茎中分离出的内生真菌Phialocephala podophylli(菌株PPE7)在肉汤培养基中生长,能积累可检测的鬼臼毒素.Arneaud等[86]从PPE7基因组中克隆得到编码SDH的基因,在毕赤酵母(Pichia pastoris)体内成功实现SDH的异源表达,并检测到罗汉松脂素的生成.Marques等[87]对桃儿七和足叶草进行了转录组测序和生物信息学分析,分别筛选到了负责催化pluviatolide生成的 CYP719A23和CYP719A24.这种策略有利于鬼臼毒素后续反应的关键酶的鉴定,也为其他复杂木脂素化合物合成路径的解析提供参考. ...
Next generation sequencing in predicting gene function in podophyllotoxin biosynthesis
1
2013
... 目前,能用于植物法提取鬼臼毒素的植物种类稀少,包括桃儿七、足叶草的根茎.由于植物生长缓慢,而鬼臼毒素的需求量大,人们尝试通过多种化学合成的方法生产鬼臼毒素.但是,化学合成法的产量低、成本高,不足以实现鬼臼毒素的商业化生产.鬼臼毒素的生物合成路径未被完全解析,无法在微生物体内实现鬼臼毒素的异源合成.在植物体内,松脂素通过PLR催化连续转化为落叶松脂素和SECO,SECO通过SDH催化生成罗汉松脂素,罗汉松脂素经过一些尚未鉴定的步骤最终合成鬼臼毒素.Kuo等[85]通过构建PLR和SDH的融合蛋白并在大肠杆菌中表达,以松脂素为底物合成罗汉松脂素(图5)的转化率能达到49.8%.从足叶草的根茎中分离出的内生真菌Phialocephala podophylli(菌株PPE7)在肉汤培养基中生长,能积累可检测的鬼臼毒素.Arneaud等[86]从PPE7基因组中克隆得到编码SDH的基因,在毕赤酵母(Pichia pastoris)体内成功实现SDH的异源表达,并检测到罗汉松脂素的生成.Marques等[87]对桃儿七和足叶草进行了转录组测序和生物信息学分析,分别筛选到了负责催化pluviatolide生成的 CYP719A23和CYP719A24.这种策略有利于鬼臼毒素后续反应的关键酶的鉴定,也为其他复杂木脂素化合物合成路径的解析提供参考. ...
Redesign and reconstruction of a steviol-biosynthetic pathway for enhanced production of steviol in Escherichia coli
1
2020
... 通过大肠杆菌实现松脂素向罗汉松脂素在体内的生物转化效率依然受到明显的限制,还需要进一步优化代谢路径,比如挖掘更高效的PLR和SDH提高罗汉松脂素的产率,选择合适的连接肽[88]优化PLR和SDH的表达水平.目前,基因片段的高效组装[89]、模式微生物的启动子文库的构建和筛选[90-92]、高效的基因组编辑[93]和蛋白质的理性设计等为微生物细胞工厂的构建提供了优良的条件.木脂素合成代谢路径的解析和微生物细胞工厂的优化,势必为木脂素在微生物中的合成开启新的时代. ...
Enzymatic assembly of DNA molecules up to several hundred kilobases
1
2009
... 通过大肠杆菌实现松脂素向罗汉松脂素在体内的生物转化效率依然受到明显的限制,还需要进一步优化代谢路径,比如挖掘更高效的PLR和SDH提高罗汉松脂素的产率,选择合适的连接肽[88]优化PLR和SDH的表达水平.目前,基因片段的高效组装[89]、模式微生物的启动子文库的构建和筛选[90-92]、高效的基因组编辑[93]和蛋白质的理性设计等为微生物细胞工厂的构建提供了优良的条件.木脂素合成代谢路径的解析和微生物细胞工厂的优化,势必为木脂素在微生物中的合成开启新的时代. ...
Obtaining a panel of cascade promoter-5'-UTR complexes in Escherichia coli
1
2017
... 通过大肠杆菌实现松脂素向罗汉松脂素在体内的生物转化效率依然受到明显的限制,还需要进一步优化代谢路径,比如挖掘更高效的PLR和SDH提高罗汉松脂素的产率,选择合适的连接肽[88]优化PLR和SDH的表达水平.目前,基因片段的高效组装[89]、模式微生物的启动子文库的构建和筛选[90-92]、高效的基因组编辑[93]和蛋白质的理性设计等为微生物细胞工厂的构建提供了优良的条件.木脂素合成代谢路径的解析和微生物细胞工厂的优化,势必为木脂素在微生物中的合成开启新的时代. ...
Promoter-library-based pathway optimization for efficient (2S)-naringenin production from p-coumaric acid in Saccharomyces cerevisiae
2020
Obtaining a series of native gradient promoter-5'-UTR sequences in Corynebacterium glutamicum ATCC 13032
1
2020
... 通过大肠杆菌实现松脂素向罗汉松脂素在体内的生物转化效率依然受到明显的限制,还需要进一步优化代谢路径,比如挖掘更高效的PLR和SDH提高罗汉松脂素的产率,选择合适的连接肽[88]优化PLR和SDH的表达水平.目前,基因片段的高效组装[89]、模式微生物的启动子文库的构建和筛选[90-92]、高效的基因组编辑[93]和蛋白质的理性设计等为微生物细胞工厂的构建提供了优良的条件.木脂素合成代谢路径的解析和微生物细胞工厂的优化,势必为木脂素在微生物中的合成开启新的时代. ...
Multigene editing in the Escherichia coli genome via the CRISPR-Cas9 system
1
2016
... 通过大肠杆菌实现松脂素向罗汉松脂素在体内的生物转化效率依然受到明显的限制,还需要进一步优化代谢路径,比如挖掘更高效的PLR和SDH提高罗汉松脂素的产率,选择合适的连接肽[88]优化PLR和SDH的表达水平.目前,基因片段的高效组装[89]、模式微生物的启动子文库的构建和筛选[90-92]、高效的基因组编辑[93]和蛋白质的理性设计等为微生物细胞工厂的构建提供了优良的条件.木脂素合成代谢路径的解析和微生物细胞工厂的优化,势必为木脂素在微生物中的合成开启新的时代. ...





 京公网安备 11010102001995号
京公网安备 11010102001995号